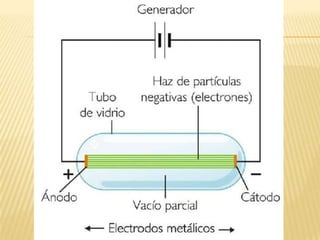
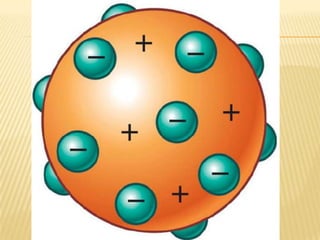
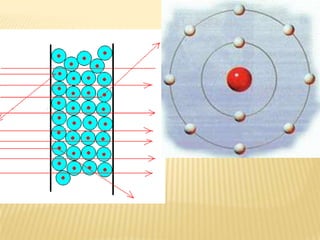
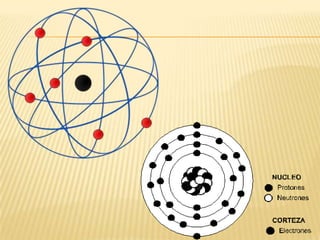
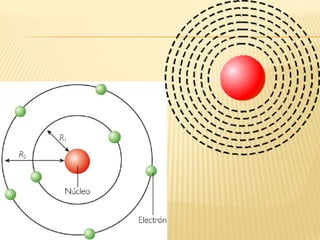
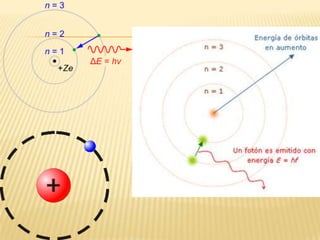
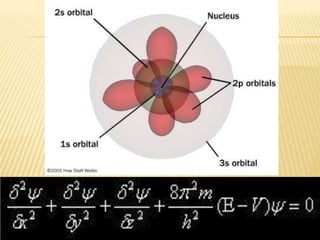
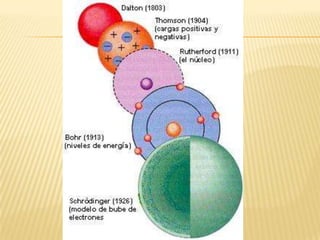
Este documento resume las teorías atómicas de Dalton, Thomson, Rutherford, Bohr, y Schrödinger. Explica que Dalton propuso que los átomos son indestructibles y que los elementos químicos están formados por átomos idénticos. Thomson descubrió el electrón. Rutherford descubrió el núcleo atómico a través de experimentos de dispersión. Bohr resolvió problemas en el modelo de Rutherford al proponer que los electrones orbitan en niveles de energía. Finalmente, la ecuación de Schröding