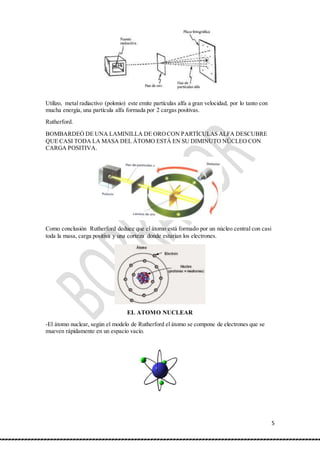
El documento resume las principales teorías atómicas desde los filósofos griegos hasta el descubrimiento del neutrón. Demócrito propuso que la materia estaba compuesta de átomos indivisibles. Dalton estableció la teoría atómica moderna, proponiendo que los átomos no se crean ni destruyen. Rutherford descubrió el núcleo atómico a través de experimentos con partículas alfa. Más tarde, Chadwick descubrió el neutrón en el núcleo atómico.