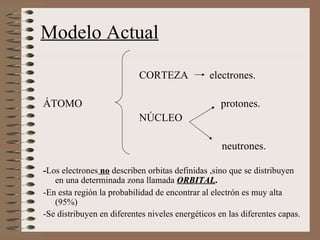
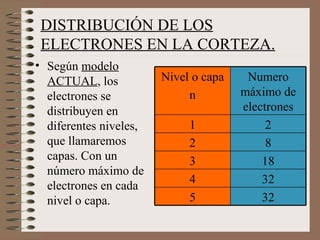
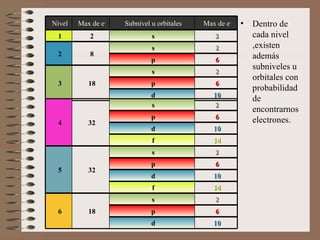
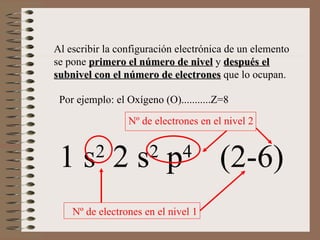
El documento explica la estructura atómica de la materia. Los átomos en los sólidos están fuertemente unidos, mientras que en los líquidos y gases están más separados. Los átomos contienen protones y neutrones en el núcleo, y electrones en la corteza. El modelo atómico actual muestra que los electrones se distribuyen en niveles de energía y orbitales alrededor del núcleo.