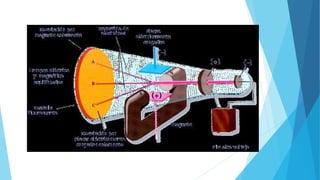
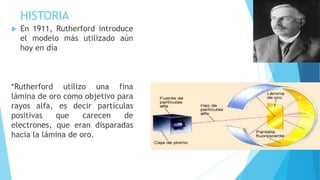
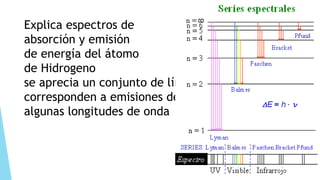
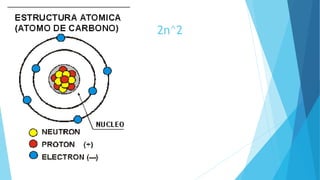
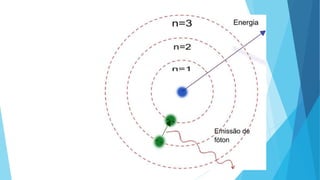
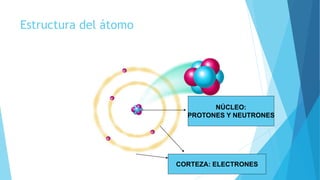
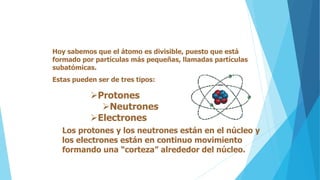
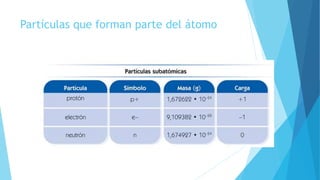
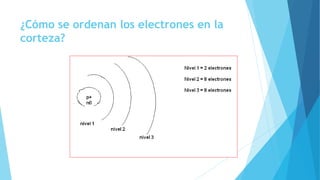
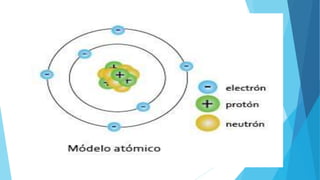
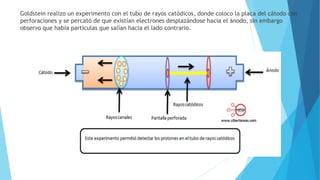
El documento describe la evolución del modelo atómico desde Dalton hasta Chadwick, incluyendo los modelos de Thomson, Rutherford, Bohr, Sommerfeld y Goldstein. Rutherford propuso que el átomo consiste principalmente en espacio vacío con un núcleo denso y positivamente cargado alrededor del cual giran los electrones. Bohr introdujo la mecánica cuántica al modelo, sugiriendo que los electrones solo pueden ocupar órbitas discretas. Sommerfeld propuso órbitas elípticas. Chadwick descubrió el