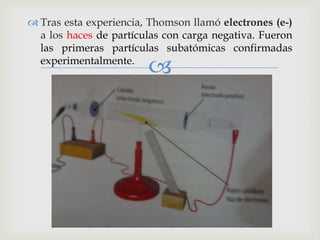
El documento describe la evolución de los modelos atómicos a través de la historia, comenzando con la idea de átomo propuesta por Demócrito en la antigüedad. Luego presenta los modelos de Dalton, Thomson, Rutherford, Bohr, Sommerfeld y Schrödinger, los cuales fueron mejorando la comprensión de la estructura atómica a través de nuevos descubrimientos experimentales. Cada modelo introdujo conceptos como el electrón, el núcleo atómico y los niveles cuánticos de energía, ac