El módulo 4 aborda el manejo del paciente crítico, enfocándose en la monitorización de la función respiratoria y la optimización de la oxigenación. Se destacan la importancia de la gasometría y los índices de oxigenación, como el PAFI, para evaluar el estado ventilatorio y la perfusión tisular. Además, se enfatiza la relevancia de los biomarcadores bioquímicos y la monitorización continua en la terapia intensiva para mejorar la atención y prevenir complicaciones.


























































































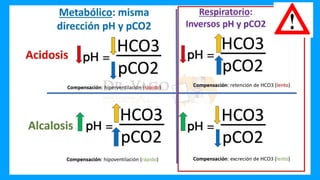





![REGLAS PARA LOS TRASTORNOS ÁCIDO-BASE RESPIRATORIOS
Regla 1: La regla de 1 por 10 para la acidosis respiratoria aguda
El [HCO3-] aumentará en 1 mmol/l por cada aumento de 10 mmHg de pCO2 por
encima de 40 mmHg.
Esperado [ 3 ] = 24 + ( C 2real 40)/10
𝐻𝐶𝑂 − 𝑝 𝑂 −
Comentario: El aumento de CO2 cambia el equilibrio entre CO2 y HCO3- para dar
como resultado un aumento agudo de HCO3-. Este es un evento fisicoquímico simple
y ocurre casi inmediatamente.
Ejemplo : un paciente con acidosis respiratoria aguda (pCO2 60 mmHg) tiene un
[HCO3-] real de 31 mmol/l. El [HCO3-] esperado para esta elevación aguda de la pCO2
es 24 + 2 = 26 mmol/l. El valor real medido es mayor que esto, lo que indica que
también debe estar presente una alcalosis metabólica.](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-102-320.jpg)
![Regla 2: La regla de 4 por 10 para la acidosis respiratoria crónica
El [HCO 3-] aumentará en 4 mmol/l por cada aumento de 10 mmHg de pCO2 por
encima de 40 mmHg.
Esperado [ 3] = 24 + 4x( O2 real 40)/10
𝐻𝐶𝑂− 𝑝𝐶 −
Comentario: con la acidosis crónica, los riñones responden reteniendo HCO3, es
decir, se produce una compensación renal. Esto tarda unos días en alcanzar su
valor máximo.
Ejemplo : un paciente con acidosis respiratoria crónica (pCO2 60 mmHg) tiene una
[HCO3-] real de 31 mmol/l. El [HCO3-] esperado para esta elevación crónica de
pCO 2 es 24 + 8 = 32 mmol/l. El valor real medido es extremadamente cercano a
este, por lo que la compensación renal es máxima y no hay evidencia que indique
un segundo trastorno acidobásico.](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-103-320.jpg)
![Regla 3: La regla 2 por 10 para la alcalosis respiratoria aguda
El [HCO3-] disminuirá en 2 mmol/l por cada 10 mmHg de disminución en la
pCO2 por debajo de 40 mmHg.
Esperado [ 3] = 24 2x(40 O2 real)/10
𝐻𝐶𝑂− − − 𝑝𝐶
Comentario : En la práctica, este cambio físico químico agudo rara vez da
como resultado una [HCO3-] inferior a unos 18 mmol/s. (¡Después de todo,
hay un límite de cuán bajo puede caer la pCO2 ya que los valores negativos
no son posibles!) Por lo tanto, un [HCO3-] de menos de 18 mmol/l indica una
acidosis metabólica coexistente.](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-104-320.jpg)
![Regla 4: La regla de 5 por 10 para una alcalosis respiratoria crónica
El [HCO3-] disminuirá en 5 mmol/l por cada 10 mmHg de disminución en la
pCO2 por debajo de 40 mmHg.
Esperado [ 3] = 24 5x(40 O2real)/10 (rango:±2)
𝐻𝐶𝑂− − − 𝑝𝐶
Comentarios:
Se necesitan de 2 a 3 días para alcanzar la compensación renal máxima
El límite de compensación es un [HCO3-] de aproximadamente 12 a 15
mmol/l](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-105-320.jpg)
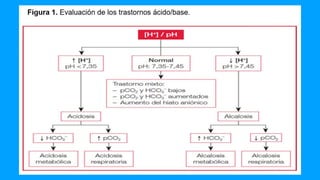
![REGLAS PARA LOS TRASTORNOS METABÓLICOS ACIDOBÁSICOS
Regla 5: La regla de uno y medio más 8 - para una acidosis metabólica
La pCO2 esperada (en mmHg) se calcula a partir de la siguiente fórmula:
[ 2]esp = 1.5×[ 3]+8 (rango:± 2 )
𝑝𝐶𝑂 𝐻𝐶𝑂−
Comentarios:
La compensación máxima puede tardar entre 12 y 24 horas en alcanzarse. El límite de
compensación es una pCO2 de unos 10 mmHg
La hipoxia puede aumentar la cantidad de estimulación de los quimiorreceptores periféricos
Ejemplo: Un paciente con acidosis metabólica ([HCO3-] 14 mmol/l) tiene una pCO2 real de 30 mmHg. La
pCO2 esperada es 29 mmHg. Básicamente, esto coincide con el valor real de 30, por lo que la
compensación es máxima y no hay evidencia de un trastorno ácido-base respiratorio (siempre que haya
pasado suficiente tiempo para que la compensación haya alcanzado este valor máximo). Si la pCO2 real
fue de 45 mmHg y la esperada de 29 mmHg, entonces esta diferencia (45-29) indicaría la presencia de una
acidosis respiratoria e indicaría su magnitud.](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-106-320.jpg)
![Regla 6: La regla del 0.7 más 20 - para una alcalosis metabólica
La pCO2 esperada (en mmHg) se calcula a partir de la siguiente fórmula:
Esperado [ 2] = 0.7x[ 3] + 20 (rango: ± 5 )
𝑝𝐶𝑂 𝐻𝐶𝑂−
Comentario: La variación en pCO2 predicha por esta ecuación es
relativamente grande.](https://image.slidesharecdn.com/0506070809modulo4respiratoriocscbrosello-240909032242-9a6382d5/85/Modulo_4-_Respiratorio-CSCB_ROSELLO-pptx-107-320.jpg)































