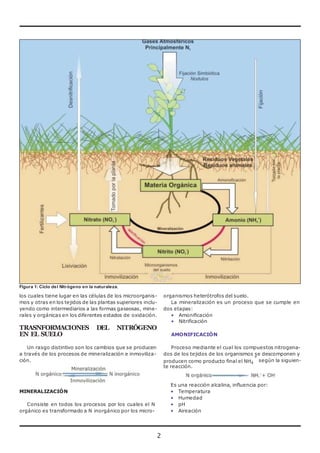
El documento trata sobre el nitrógeno del suelo. Explica que el nitrógeno es esencial para las plantas y parte del ciclo biogeoquímico entre la atmósfera, el suelo y los organismos. Describe los procesos de mineralización e inmovilización que convierten el nitrógeno entre formas orgánicas e inorgánicas, así como los factores que afectan estos procesos. También menciona las ganancias y pérdidas de nitrógeno en el suelo a través de procesos