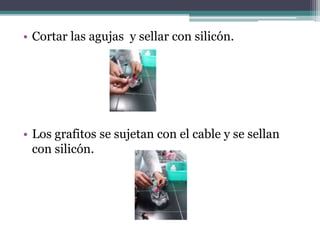
La práctica de laboratorio describe el proceso de electrólisis de una solución acuosa de yoduro de potasio. Al aplicar corriente eléctrica, los iones se separan, con la oxidación del yodo en el ánodo y la reducción del potasio en el cátodo, lo que produce cambios de color en cada electrodo.