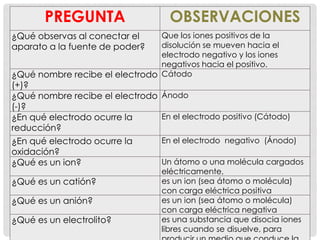
La electrólisis de yoduro de potasio separa los iones de la sal en sus componentes. En el cátodo (electrodo positivo), el potasio se reduce formando hidróxido de potasio y hidrógeno. En el ánodo (electrodo negativo), el yodo se oxida formando yodo elemental. La electrólisis es un proceso redox que separa los iones de una sal inorgánica en sus elementos constituyentes a través de las reacciones de oxidación y reducción en los electrodos.