El documento describe un procedimiento para preparar mezclas de ácido acético y acetato de sodio en diferentes volúmenes y medir su pH. Se prepararon 5 vasos precipitación con variaciones en los volúmenes del ácido y la base. Se midió el pH de cada mezcla y se comparó con el pH teórico calculado usando la ecuación de Henderson-Hasselbalch. Los resultados mostraron diferencias pequeñas entre el pH práctico y teórico.
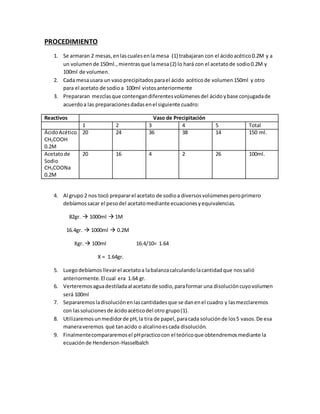


![Vaso N° 5.- pH=4.7 (acido)
- Para hallarel pH teórico usamos la ecuaciónde Henderson-Hasselbalch
pH=-logKa+ log [CH3COONa]/[CH3COOH]
Concentración= 0.2M log[CH3COONa]/[CH3COOH] =0
pH= - log1.79x10-5
pH= 4.75
pH=4.7](https://image.slidesharecdn.com/procedimientoyresultados-150617045059-lva1-app6891/85/Procedimiento-y-resultados-4-320.jpg)
