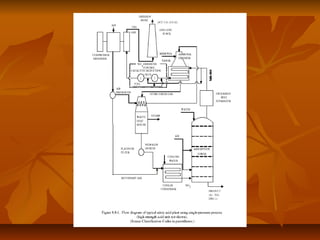
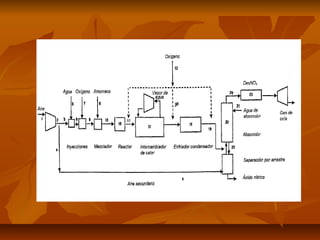
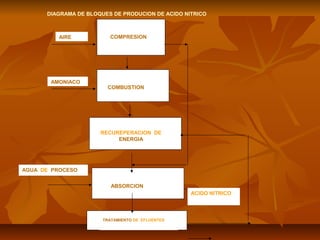
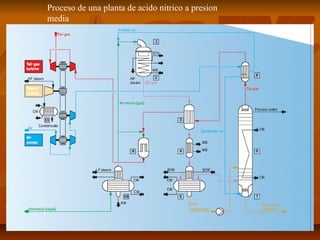
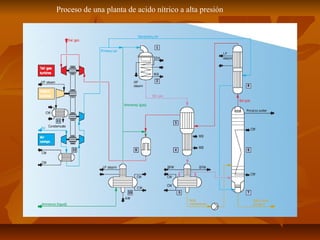
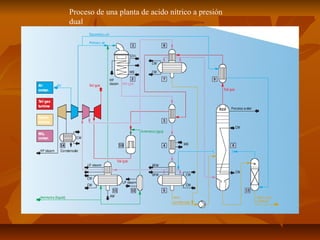
El documento describe el proceso de producción de ácido nítrico (HNO3), el cual se produce mediante la oxidación catalítica del amoníaco con aire y oxígeno sobre un catalizador de platino. El HNO3 se utiliza ampliamente en la industria para la producción de fertilizantes, explosivos y otros productos químicos. El proceso industrial más común implica la reacción del amoníaco y el aire para formar óxido nítrico, el cual se oxida posteriormente a dióxido de nitrógeno y se absor










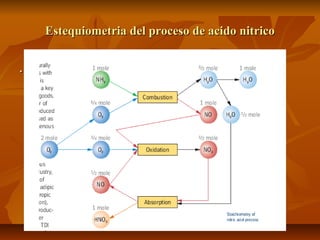
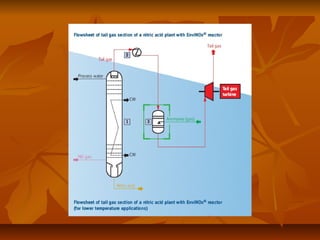

![ El proceso SCR está basado en la reducción de
los NOx con NH3, en presencia de
exceso de O2 y un catalizador apropiado, para
transformarse en sustancias inocuas tales como
agua y nitrógeno de acuerdo a las siguientes
reacciones [4]:](https://image.slidesharecdn.com/prodacidonitrico11-131008171430-phpapp01/85/Produccion-del-acido-nitrico-18-320.jpg)