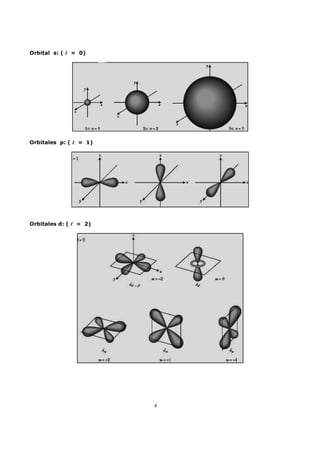
El documento describe los conceptos fundamentales de la mecánica cuántica y la configuración electrónica de los átomos. Explica que los electrones se distribuyen en niveles de energía cuánticos definidos por cuatro números cuánticos. También describe los principios que rigen cómo los electrones se distribuyen en los orbitales atómicos y proporciona ejemplos de configuraciones electrónicas de varios elementos.