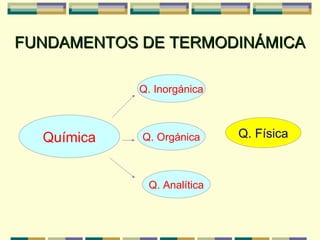
Este documento presenta conceptos básicos de termodinámica como sistemas, variables de estado, procesos termodinámicos, equilibrio y temperatura. Explica que un sistema puede ser abierto, cerrado o aislado dependiendo de si intercambia materia o energía con el exterior. Las variables de estado caracterizan los estados termodinámicos y están relacionadas a través de ecuaciones de estado. Los procesos pueden ser isotermos, isobaros u otros dependiendo de qué variable se mantenga constante.















![TEMPERATURA [K] [ºC] La temperatura es una propiedad intensiva del sistema, relacionada con la energía cinética media de las moléculas que lo constituyen. Su cambio supone el cambio repetitivo y predecible en otras propiedades del sistema, lo que permite asignarle un valor numérico](https://image.slidesharecdn.com/introducciontransparencias-1227285294761680-9/85/sadfsd-17-320.jpg)




