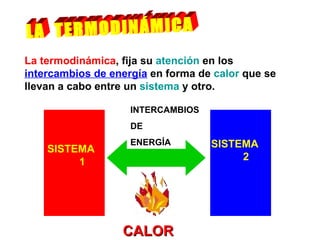
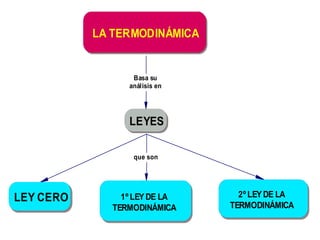
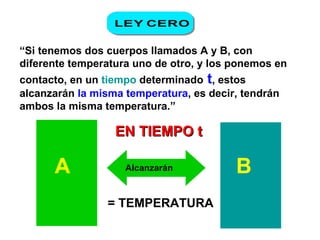
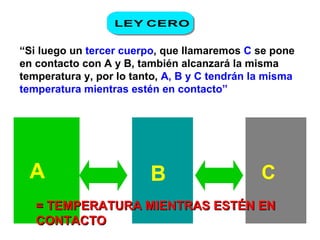
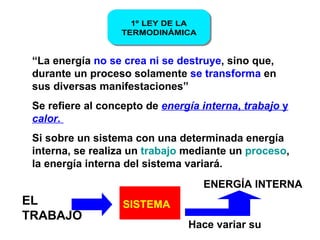
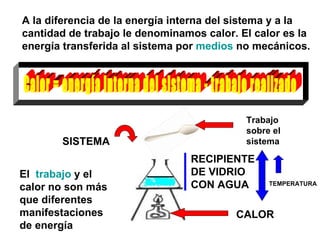
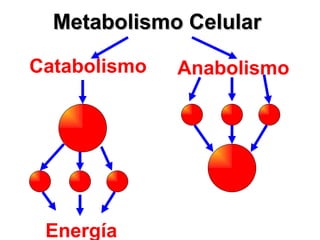
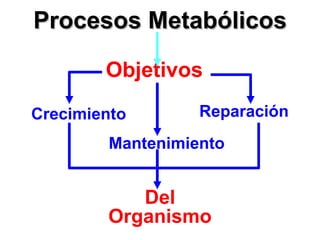
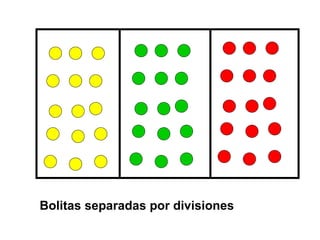
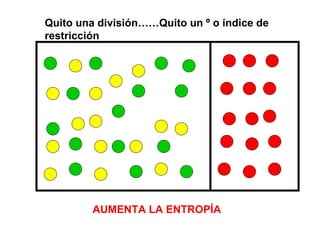
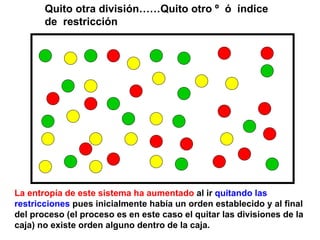
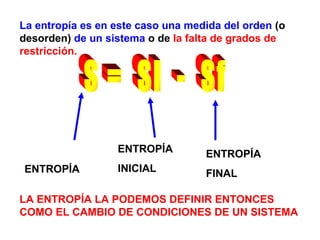
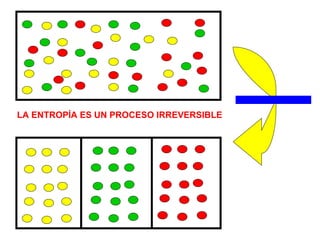
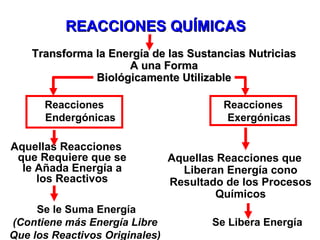
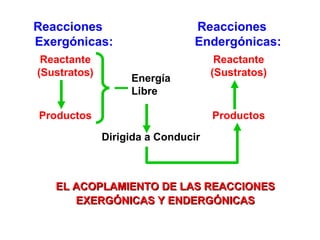
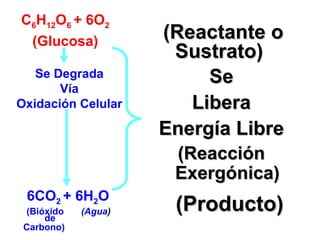
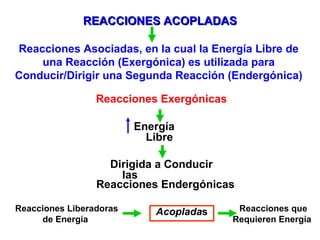
El documento habla sobre los conceptos fundamentales de la termodinámica como los intercambios de energía en forma de calor entre sistemas, y que dos cuerpos en contacto alcanzarán la misma temperatura con el tiempo. También explica que la energía no se crea ni destruye, sino que se transforma en diferentes manifestaciones como trabajo o calor.