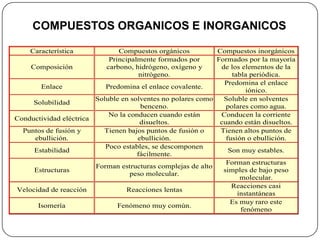
Este documento trata sobre la química orgánica y los compuestos de carbono. Explica las diferencias entre compuestos orgánicos e inorgánicos, y describe las propiedades del átomo de carbono, incluyendo su número atómico, configuración electrónica y masa atómica. También discute los tipos de enlaces de carbono, cadenas e isomería, tipos de carbono en una cadena, y los conceptos de hibridación sp, sp2 y sp3.