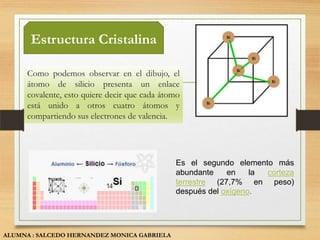
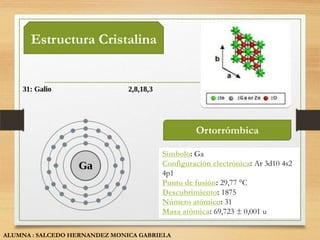
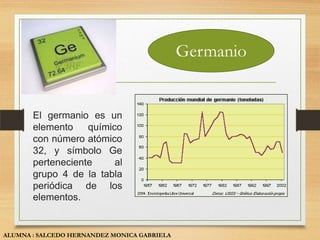
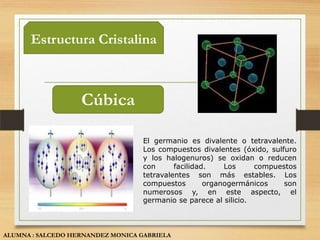
El documento describe las propiedades y usos de tres sólidos cristalinos: el silicio, galio y germanio. El silicio se presenta en forma amorfa o cristalina y se utiliza principalmente en la fabricación de chips de computadora. El galio es un metal blando que se utiliza como semiconductor. El germanio es un semiconductor que se usa en transistores y detectores infrarrojos.