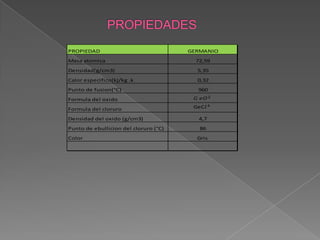
El documento describe las propiedades y aplicaciones del silicio, germanio y galio. El silicio se utiliza ampliamente en la electrónica debido a su capacidad semiconductor. El germanio se usa como semiconductor y en detectores infrarrojos. El galio tiene un bajo punto de fusión y se emplea en aleaciones, semiconductores y detectores de neutrinos.



![PROPIEDADES FISICAS:
El silicio es un elemento químico de aspecto gris oscuro
azulado
El estado del silicio en su forma natural es solido.
El numero atómico del silicio es 14.
El símbolo químico del silicio es Si.
El punto de fusión del silicio es de 16,7 grados kelvin .
El punto de ebullición del silicio es de 31,3grados kelvin.
Velocidad del sonido _m/sa_K
Presión de vapor 4,77pa a 1683k
PROPIEDADES ATOMICAS:
Masa atómica 28,0855u
Radio medio +110pm
Radio covalente111pm
Radio de van der Wells 210pm
Configuración electrónica [Ne]3s2 3p2
Estructura cristalina cúbica centrada en las caras.
Estado de oxidación 4 anfótero](https://image.slidesharecdn.com/solidoscristalinos-131215221258-phpapp02/85/Solidos-cristalinos-4-320.jpg)