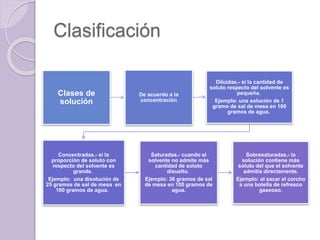
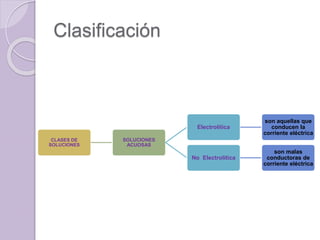
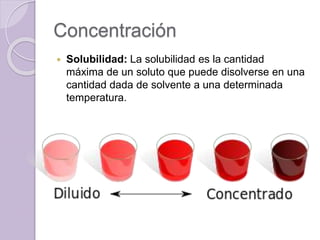
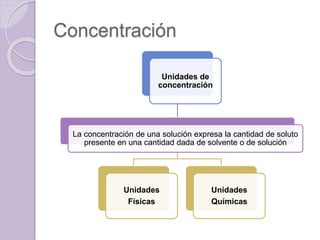
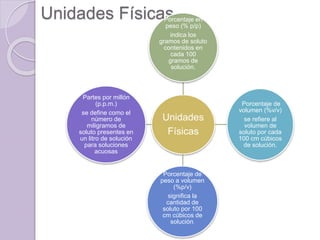
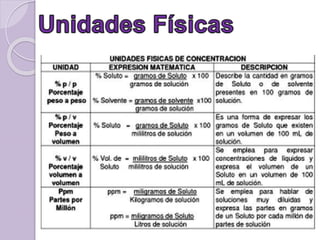
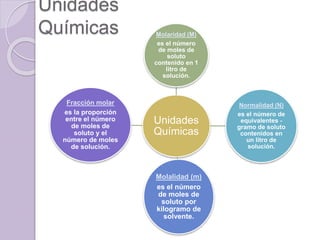
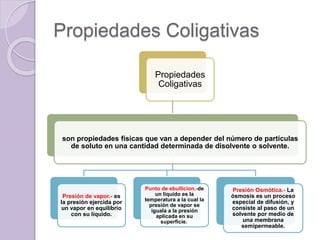
Este documento define una solución como una mezcla homogénea a nivel molecular o iónico de dos o más sustancias que no reaccionan entre sí. Explica que las soluciones se clasifican como diluidas, concentradas, saturadas o sobresaturadas dependiendo de la proporción de soluto y solvente. También describe diferentes unidades para medir la concentración de una solución como porcentaje, molaridad y molalidad.