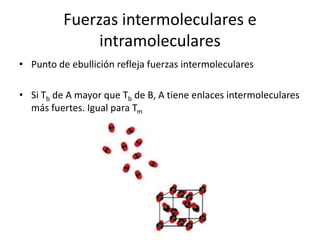
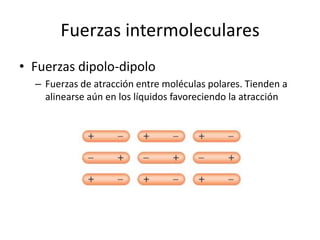
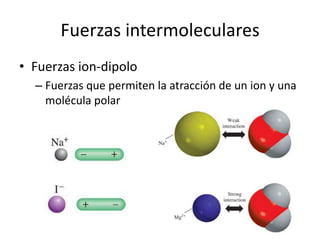
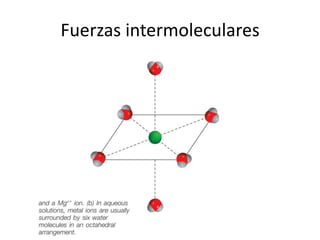
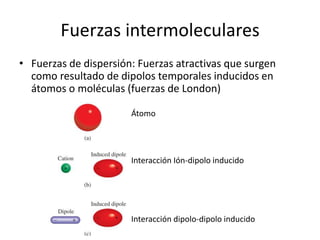
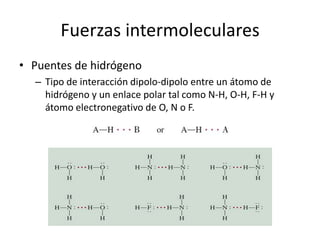
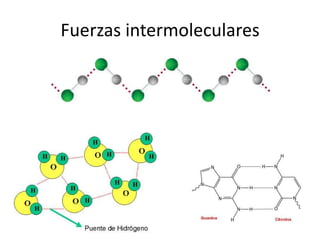
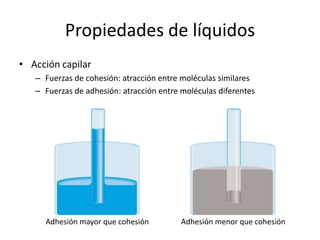
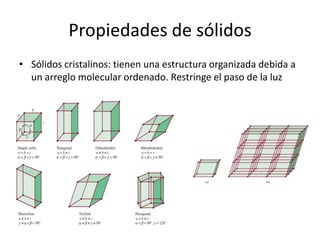
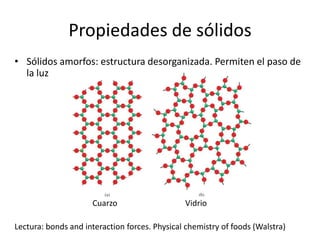
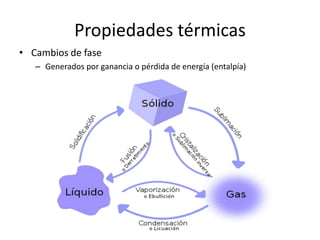
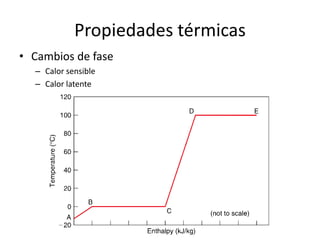
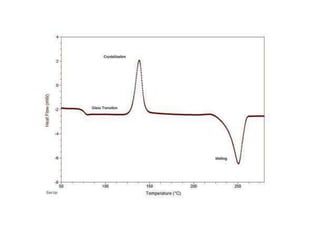
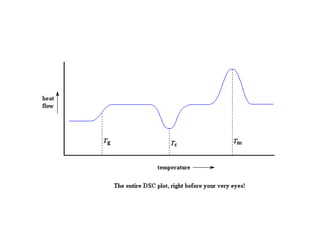
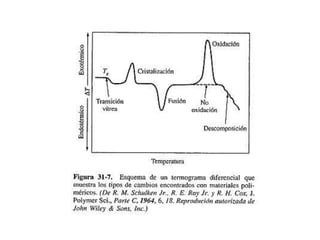
Este documento describe las propiedades de los sólidos, líquidos y gases. Explica que la distancia entre las moléculas determina si una sustancia es un sólido, líquido o gas, y que las fuerzas intermoleculares e intramoleculares afectan las propiedades térmicas como los puntos de fusión y ebullición. También cubre conceptos como tensión superficial, viscosidad, cambios de fase y cómo se miden propiedades térmicas.