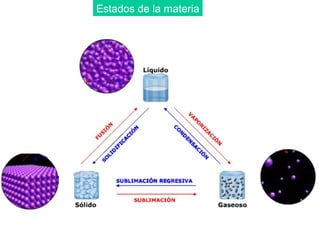
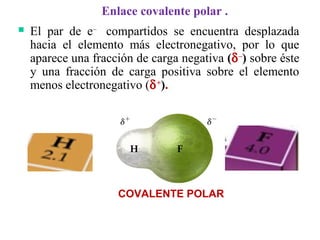
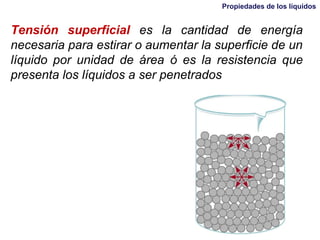
Este documento resume las propiedades de los líquidos, incluyendo las fuerzas intermoleculares que determinan su comportamiento, como la tensión superficial y la viscosidad. Explica cómo factores como la temperatura y la adición de otras sustancias afectan estas propiedades. También describe conceptos como el equilibrio líquido-vapor y cómo la presión de vapor de un líquido depende de la temperatura.