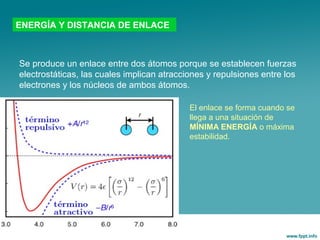
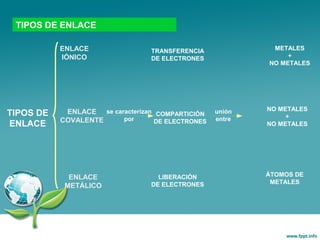
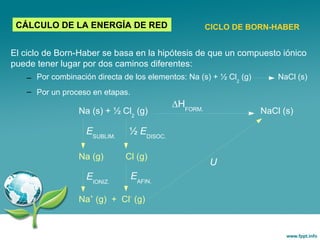
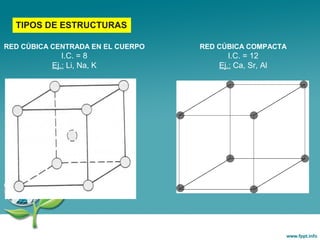
Este documento trata sobre los diferentes tipos de enlace químico, incluyendo el enlace iónico y el enlace metálico. Explica que el enlace iónico implica la transferencia de electrones entre átomos, formando iones que se unen por atracción electrostática. Los compuestos iónicos forman redes cristalinas y son sólidos con alta temperatura de fusión. El enlace metálico implica la compartición de electrones entre átomos metálicos, formando una estructura de banda de energía que da como resultado