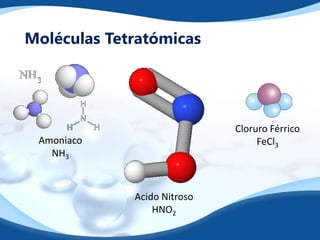
El documento explora la naturaleza de las moléculas y los iones, destacando que los átomos normalmente se combinan para formar moléculas, las cuales pueden ser diatómicas, triatómicas, tetratómicas, o pentatómicas. Los iones, que son átomos con carga neta, se clasifican en cationes y aniones, y se representan con un símbolo que indica su carga. Además, se analizan las aplicaciones de los iones en procesos químicos, como la electrólisis y la formación de cristales.