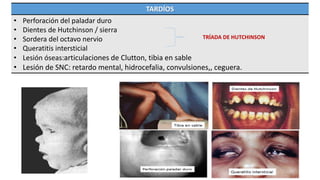
1) El documento describe diferentes infecciones maternas que pueden afectar al feto durante la gestación, incluyendo toxoplasmosis, sífilis, rubéola, citomegalovirus y herpes.
2) Estas infecciones pueden transmitirse al feto y causar complicaciones congénitas como defectos del corazón, sordera, retraso mental y otros problemas de salud.
3) El documento proporciona información sobre la epidemiología, vías de transmisión, síntomas, diagnóstico y tratamiento de estas infecciones matern