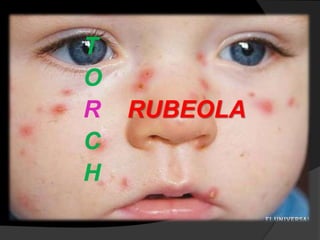
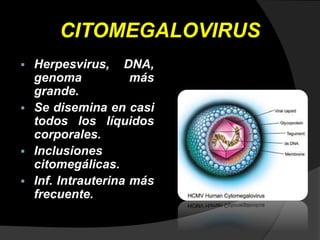
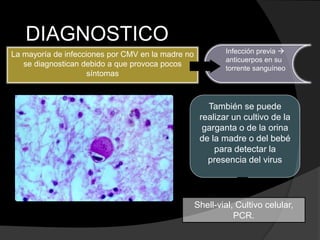
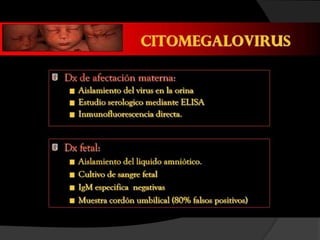
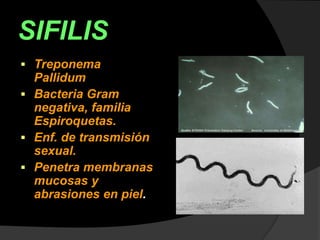
Este documento describe el síndrome TORCH, que incluye infecciones virales y parasitarias que pueden transmitirse de una madre embarazada a su feto. Define cada infección incluida (toxoplasmosis, rubeola, citomegalovirus, herpes y sífilis) y describe sus vías de transmisión, manifestaciones clínicas, diagnóstico y tratamiento. El documento provee información detallada sobre cada patógeno y la importancia de evaluar a todas las pacientes embarazadas para minimizar el riesgo de infección cong