Unidad 1 materia y energia .ppsx
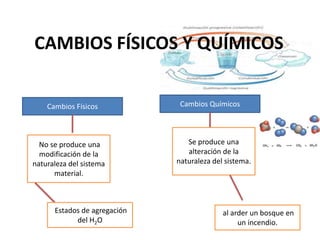
- 1. CAMBIOS FÍSICOS Y QUÍMICOS Cambios Físicos Cambios Químicos No se produce una Se produce una modificación de la alteración de la naturaleza del sistema naturaleza del sistema. material. Estados de agregación al arder un bosque en del H2O un incendio.
- 2. En los siguientes hechos ocurren cambios físicos o químicos, o ambos. ¿Cuáles son de cada especie? La deformación de una pastilla El calentamiento en un horno El horneado de un pastel La corrosión de un metal La preparación de un café La cocción de un huevo La luxación de un hueso La floración de una planta Un golpe de la raqueta
- 3. La materia Solida gaseosa liquida
- 4. La materia Fase Propiedades objetos Solida Ocupan un volumen fijo y tiene Hielo,madera,metal forma definida Liquida Ocupan volumen fijo, pero Agua, gasolina, alcohol conservan la forma del recipiente Gaseosa No tiene volumen fijo, ni una Vapor, butano, aire forma definida
- 5. La materia Moléculas
- 7. Mezclas heterogéneas Estado de agregación Ejemplos Solido/solido Ensalada de frutas, una caja de herramienta en desorden, una bolsa de canicas, granito(cuarzo, feldespato y mica), bauxita, ferrita, mármol Solido/ liquido Café en agua, arena en agua Solido/gas Gases del escape de los autos, que contienen partículas solidas de carbón Liquido/liquido agua y aceite Liquido/ gas Cerveza y refrescos de cola, con el CO2 contenido en ellos
- 8. Mezclas homogéneas Estado de agregación Ejemplos solido Aleaciones metálicas como el acero( que contienen hierro y carbón), amalgamas (plata y mercurio) liquido El agua de mar, aceite y benceno, agua con sal, agua y alcohol. gas La mezcla de cualquier tipo de gases (aire), el gas de cocina(gas butano)
- 9. Mezclas a sustancias puras Mezclar es fácil. Lo difícil es volver a separar Se aprovecha el hecho de que los diversos componentes de una mezcla tiene diferentes propiedades físicas y químicas. Técnica de separación principio filtración Baja solubilidad Destilación Diferencia en punto de ebullición Sublimación Diferencia en punto de sublimación Extracción Diferencia de solubilidad en dos disolventes inmiscibles Cristalización Diferencia de solubilidad en disolventes fríos y calientes cromatografía Diferencia de movilidad de una sustancia que migra a través de un soporte Sedimentación, decantación
- 10. Coloca una X después del nombre de cada una de las sustancias para clasificarlas en mezclas homogéneas o heterogéneas, según corresponda: Sustancia Mezcla homogénea Mezcla heterogénea Te Coctel de frutas Agua de Jamaica Mármol Nube Tolvanera Loción Gelatina con frutas Café en polvo y agua Leche
- 11. Contesta los siguientes ejercicios en equipos o individual. 1.-Un recipiente contiene sal, arena y agua, con base con ello contesta lo siguiente: a) Que tipo de mezcla se obtiene con la sal y la arena? b) Que ocurre con esa mezcla al agregarle agua? c) Son puros los componentes de las fases obtenidas en el inciso b)? 2.-La gasolina y el agua no se mezclan y sus densidades son: 0.7 g/mL y 1 g/mL a 20°C. a) Que tipo de mezcla se obtiene en este caso? b) Haz un dibujo del aspecto de la mezcla que se obtiene. 3.-El éter etílico y el alcohol etílico son dos líquidos miscibles, cuyas densidades son respectivamente, 0.71 g/mL y 0.79 g/mL a 20°C. a) Que tipo de mezcla se obtiene en este caso b) cual es el aspecto de la mezcla obtenida?
- 13. Elementos Metales No Metales Metaloides Lustre brillante Conducen el calor y Tienen propiedades No Lustre brillante electricidad intermedias entre la de los No Conducen el calor y Maleables y dúctiles electricidad metales y no metales, pero Todos sólidos a Tamb Muchos son gases a carecen de otras. Por (Hg, liquido) ejemplo, el Si “chips de Tamb (H2,N2,O2,F2), Cede fácilmente líquidos (Br2), sólidos(I2) computadoras” electrones (quebradizo, no conduce Difícilmente ceden (electropositivo) y tienes calor ni electricidad electrones energías de ionización también como los (electronegativo) bajas metales)
- 15. Actividad: Mezclados en un conjunto de letras están los nombres de los siguientes elementos: Encuéntralo en forma vertical, horizontal o diagonal Al B Cl He Li N K S Ar Be Co Rd Mg O Rb Sn As Br Cu I Mn Pd Se Ti Ba Ca F Fe Hg P Si U Be C Au Pb Ni Pt Na Zn N A D I O I D A L A P O L O N O A O A S O D I O T A R R U D A N A X L I N E M I C N I Z N S O I T O R I U N T L O T L A B O C E E O A B G D M G O E Z I A E R T X N N N O R O O I A A N T R C A H E N I E I I A N S N M F I I B H I D E Q O R T L C P E I E L O O T D I O U I D F R I M O N O R U R S R A D E T U O U O R A T A N C O S O F I L I R E R Z G E G A G E U R G O M O L P E R C A E B N S N G R O R I M E R C U R O L N I E I A I I S I L I C I O C E O D O I S O M X O O I R U C O B R N H I F R O G I O S E S T A Ñ O R U B I D I O O D U L O O M O R B I E Z A D O I S E N G A M
- 16. Solido iónico T. Fusión (°C) KCl 771 NaCl 803 PbO 897 BaSO4 1350 Compuestos iónicos • A T ambiente son sólidos cristalinos ( cristales “aniones y cationes” ) • Presentan Pf y Pe elevados • Electronegatividades muy diferentes ( iones positivos y cationes positivos) • No forman moléculas si no agregados de iones • Son duros y frágiles • En estado solido no conducen la electricidad, pero fundidos o disueltos son conductores de electricidad(electrolito)
- 17. Compuestos covalentes •Estado gaseoso( Cl2), liquido (H2O), solido( I2) •Puntos de fusión no tan levados •Electronegativas altas y muy parecidas •Ninguno de los átomos (perder o ganar electrones) •Regla del octeto (electrones entre dos átomos)” Estructura del gas noble” •Forman agregados atómicos llamadas moléculas •No conducen la electricidad •Ejemplos: H2O, CO2, y todos los compuestos orgánicos
- 18. Indica si los siguientes materiales corresponden a un elemento, compuesto puro o mezcla. Agua de mar Madera Mercurio Un trozo de níquel Gasolina Bicarbonato de sodio Vapor de agua Papel Aire
- 19. Ley de la conservación de la materia “La materia no se crea ni se destruye” ruso M. V. Lomosov, en 1756, y después por el francés Antonie Lavoisier, en 1783. La masa total de las sustancias que reaccionan es igual a la de aquellas que se producen en la reacción
- 20. ENERGÍA Y CAMBIOS La energía es todo aquello capaz de producir un trabajo ENERGÍA MASA
- 22. En la vida cotidiana, podemos adquirir energía de múltiples formas, por ejemplo: Cuando subimos por una escalera y aumenta nuestra energía potencial. Cuando el automóvil en que viajamos aumenta su velocidad. Cuando el organismo metaboliza los azucares que comemos y almacena su energía en los músculos. Cuando, al asolearnos, absorbemos la luz solar, lo que con un poco de descuido puede resultar en quemaduras en nuestra piel. No obstante, en cualquiera de estos cuatro casos también se ha perdido energía: La que aplicaron las piernas para subir, que al final de cuentas provino del alimento. La de la gasolina que el coche consumió al acelerar, cuya combustión fue aprovechada para elevar los pistones y hacer girar el cigüeñal del motor, pero para calentar los gases que salen por el escape. La que se encontraba en los enlaces químicos del azúcar, los cuales se rompieron en su combustión dentro de nuestras células. La que abandono el sol en forma de rayos luminosos, y que provino de las reacciones nucleares que ocurren en el.
- 23. ENERGÍA Y CAMBIOS Energía Potencial Energía Cinética ALTURA VELOCIDAD
- 24. TAREA: INVESTIGAR LAS DISTINTAS FORMAS DE ENERGIA
- 25. MEZCLAS O SISTEMAS DISPERSOS: SOLUCIONES, COLOIDES Y SUSPENCIONES Producirlas Separarlas
- 26. DISPERSIONES Fase dispersora y Fase dispersa Disoluciones En una mezcla las partículas de la fase dispersa tienen el tamaño de átomos o moléculas Fase Fase original del soluto Ejemplos Gaseosa gaseosa aire Liquida aire húmedo Solida algunos humos finos liquida gaseosa agua gasificada Liquida vinagre Solida agua de mar Solida gaseosa hidrogeno adsorbido en metales Liquida amalgama de mercurio Solida aleaciones
- 27. Coloides Partículas de una mezcla homogénea tiene a aproximadamente un tamaño de 10 a 10,000 veces mayor que los átomos o moléculas. Fase dispersor Fase dispersora Nombre común Ejemplos Gaseosa Liquida aerosol liquido nubes, “spray” Solida aerosol solido humo liquida gas espuma jabonadura Liquida emulsión leche, mayonesa Solida sol gelatina, pinturas Solida gas espuma solida malvaviscos, piedra pómez Liquida emulsión liquida queso, mantequilla Solida sol solido perlas
- 28. Suspensiones Tamaño promedio de las partículas de la mezcla es mayor que el caso de los coloides La fuerza de la gravedad domina sobre las iteraciones entre partículas, así que las suspensiones acaban por sedimentarse y presentan 2 fases, en forma de mezcla heterogénea Las suspensiones presentan las siguientes características cualitativas: Sus partículas son mayores que las de las soluciones y los coloides, lo que permite observarlas a simple vista Sus partículas se sedimentan si la suspensión se deja en reposo Los componentes de la suspensión pueden separarse por medio de centrifugación, decantación, filtración y evaporación.
- 29. Propiedad Disolución Coloide Suspensión Tamaño de la partícula 1 nm 10-10000nm 10 000nm homogenidad Homogénea En el limite heterogénea Acción de la gravedad No sedimenta Puede sedimentar sedimenta filtrabilidad No filtrable No filtrable filtrable Ejemplos sanguíneos Sal urea Albumina, fibrinógeno Células rojas y blancas
- 30. Actividad: Prepare el siguiente aderezo •Un vaso de yogurt de fresa o de manzana •Tres cucharadas soperas de media crema •Una cucharada de azúcar •Dos cucharadas de nuez picada •Fruta picada •Un vaso •Un plato desechable grande y tenedor Preparación: •Mezcle en un tazón todos los ingredientes •Sirvan sobre la fruta picada •Indiquen en su cuaderno que tipo de mezcla se forma al elaborar el aderezo Expliquen que ingredientes forman la fase dispersa.
- 31. CAMBIOS DE ESTADO DE LA MATERIA El estado de agregación en que este una determinada sustancia depende de la temperatura y presión a la que estén sometida.
- 33. temperatura absoluta ( el valor de la temperatura medida con respecto a una escala que comienza en el cero absoluto).
