Los elementos y sus enlaces
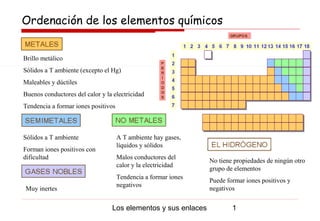
- 1. Ordenación de los elementos químicos Brillo metálico Sólidos a T ambiente (excepto el Hg) Maleables y dúctiles Buenos conductores del calor y la electricidad Tendencia a formar iones positivos Sólidos a T ambiente A T ambiente hay gases, líquidos y sólidos Forman iones positivos con dificultad Malos conductores del No tiene propiedades de ningún otro calor y la electricidad grupo de elementos Tendencia a formar iones Puede formar iones positivos y negativos Muy inertes negativos Los elementos y sus enlaces 1
- 2. Uniones de átomos Los átomos se unen con otros átomos de forma que la energía final del conjunto sea menos que la que tenían antes de unirse. Esta unión recibe el nombre de enlace químico. Existen átomos que Cuando se agrupan Si átomos o moléculas se son estables como dos o más átomos ordenan formando tal, son los gases iguales se forman macroestructuras nobles. moléculas. tridimensionales, se tienen cristales. Los elementos y sus enlaces 2
- 3. Enlace iónico El enlace iónico se debe a la atracción eléctrica entre iones positivos y negativos. Los metales forman compuestos iónicos con los no metales. Forman redes cristalinas. Los elementos y sus enlaces 3
- 4. Propiedades de los compuestos iónicos Propiedades: Son sólidos a T ambiente, con altos puntos de fusión y ebullición. Son duros, es decir, difíciles de rayar. Se fracturan al golpearlos, formando cristales de menor tamaño. Se disuelven en agua. No conducen la corriente eléctrica en estado sólido, pero son conductores en estado líquido y en disolución. Los elementos y sus enlaces 4
- 5. Interpretación de las propiedades de los compuestos iónicos Interpretación: Existe fuerte atracción entre los iones de distinto signo y se necesita mucha energía para romper la red cristalina. Al golpear el cristal se desplazan los iones y quedan enfrentados los de igual carga, Halita repeliéndose. Las moléculas de agua pueden atraer y separar los iones deshaciendo la red cristalina. Los iones al pasar al estado líquido adquieren movilidad, lo que posibilita el paso de la corriente eléctrica. Red de NaCl Los elementos y sus enlaces 5
- 6. Enlace covalente El enlace covalente se produce cuando dos átomos comparten pares de electrones para completar su capa de valencia. El modelo utilizado para describir estas uniones son las estructuras de Lewis Los elementos y sus enlaces 6
- 7. Propiedades de los compuestos covalentes Propiedades: (sustancias moleculares) Tienen bajos puntos de fusión y ebullición, por lo que son gases o líquidos a T ambiente. No se disuelven o lo hacen muy poco en agua. Molécula de Br2 No conducen la corriente eléctrica, aunque algunas lo hacen débilmente. Propiedades: (cristales covalentes) A T ambiente son sólidos muy duros, con altos puntos de fusión. No se disuelven en agua. No conducen la corriente eléctrica. Red del diamante Los elementos y sus enlaces 7
- 8. Interpretación de las propiedades de los compuestos covalentes Interpretación: (sustancias moleculares) La fuerza de enlace entre átomos es grande, pero la fuerza que mantiene unidas las moléculas es débil. En su estructura no hay iones capaces de ser atraídos por las moléculas de agua. No existen cargas eléctricas en su estructura, aunque algunas veces, se pueden formar al reaccionar con el agua. Ampolla de bromo Interpretación: (cristales covalentes) El enlace entre átomos es muy fuerte, por lo que se necesita mucha energía para romper la red cristalina. En su estructura no hay iones capaces de ser atraídos por las moléculas de agua. No existen cargas eléctricas en su estructura. Diamante Los elementos y sus enlaces 8
- 9. Enlace metálico El enlace metálico se produce cuando los iones positivos de un metal comparten una nube electrónica. Los átomos de los metales ceden sus electrones para completar sus octeto y se transforman en iones positivos. Los iones se sitúan formando una red metálica por la que se mueven los electrones libre formando una nube electrónica. Los elementos y sus enlaces 9
- 10. Propiedades de los compuestos metálicos Propiedades: Son sólidos a T ambiente, con altos puntos de fusión y ebullición. Son deformables: dúctiles y maleables. Conducen la corriente eléctrica tanto en Hierro estado sólido como líquido. Los elementos y sus enlaces 10
- 11. Interpretación de las propiedades de los compuestos metálicos Interpretación: Se necesita bastante energía para mover la red cristalina metálica. Al deformarlos no hay repulsión entre cargas y no se fracturan. Los electrones de la capa exterior se desplazan en el interior del metal. Los elementos y sus enlaces 11
