Hidrocarburos
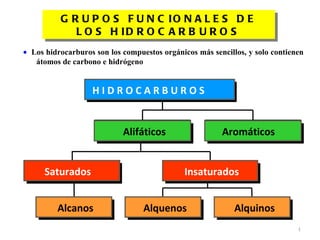
- 1. G R U P O S F U N C IO N A L E S D E L O S H ID R O C A R B U R O S • Los hidrocarburos son los compuestos orgánicos más sencillos, y solo contienen átomos de carbono e hidrógeno HIDROCARBUROS Alifáticos Aromáticos Saturados Insaturados Alcanos Alquenos Alquinos 1
- 2. H ID R O C A R B U R O S S A T U R A D O S O ALC ANOS • Son aquellos hidrocarburos en los que todos sus enlaces son sencillos Grupo Hibridación Geometría del Fórmula Nomenclatura Funcional del C C Global Alcano sp3 tetraédrica CnH2n+2 R-ano PROPIEDADES FISICAS Punto de ebullición: el punto de ebullición aumenta con el tamaño del alcano porque las fuerzas intermoleculares (fuerzas de Van der Waals y de London), son más efectivas cuando la molécula presenta mayor superficie. Es así, que los puntos de fusión y ebullición van a aumentar a medida que se incrementa el número de átomos de carbono. Punto de fusión: El punto de fusión también aumenta con el tamaño del alcano por la misma razón que aumenta el punto de ebullición. Densidad: a medida que aumenta el número de carbonos, las fuerzas intermoleculares son mayores y por lo tanto la cohesión intermolecular Solubilidad: Los alcanos por ser compuestos apolares no se disuelven en agua, sino en solventes no polares como el benceno, éter y cloroformo.
- 3. Propiedades químicas Oxidación completa (Combustión): los alcanos se oxidan en presencia de aire u oxígeno y el calor de una llama, produciendo dióxido de carbono, luz no muy luminosa y calor. CnH2n+2 + (1,5n+0,5)O2 → (n+1)H2O + nCO2 Pirólisis o cracking: este es un proceso usado en la industria petrolera y consiste en pasar un alcano pesado por tubos calentados de 500 º a 800 ºC lo que permite que el compuesto se descomponga en alquenos e hidrógeno. Reacciones con halógenos Los alcanos reaccionan con halógenos en la denominada reacción de halogenación radicalaria. Isomerización y reformado La isomerización y reformado son procesos en los que los alcanos de cadena lineal son calentados en presencia de un catalizador de platino. En la isomerización, los alcanos se convierten en sus isómeros de cadena ramificada. En el reformado, los alcanos se convierten en sus formas cíclicas o en hidrocarburos aromáticos, liberando hidrógeno como subproducto. 3
- 4. H ID R O C A R B U R O S C O N D O B L E S E N L A C E S : ALQUENOS • La posición del doble enlace, se indica con un localizador, empezando a numerar la cadena por el extremo más próximo al doble enlace • El localizador es el número correspondiente al primer carbono del doble enlace y se escribe delante del nombre separado por un guión • Se nombran sustituyendo la terminación − ano, por − eno • Si el alqueno tiene dos o más dobles enlaces, numeramos la cadena asignando a los dobles, los localizadores más bajos • Se utilizan las terminaciones − dieno, − trieno 4 3 2 1 1 2 3 4 CH3 − CH = CH2 CH3 − CH2 − CH = CH2 CH3 − CH2 = CH − CH3 propeno 1−buteno 2−buteno 5 4 3 2 1 1 2 3 4 5 6 7 8 CH3 − CH = CH − CH = CH2 CH2 = CH − CH = CH − CH2 − CH = CH − CH3 1,3 − pentadieno 1,3,6 − octatrieno 4
- 5. Grupo Hibridación Geometría del Fórmula Nomenclatura Funcional del C C Global Alqueno sp2 trigonal plana CnH2n R-eno Propiedades físicas de los alquenos: Son insolubles en agua, pero bastante solubles en líquidos no polares, son menos densos que el agua. el punto de ebullición aumenta con el número creciente de carbonos; el aumento del punto de ebullición es de 20 a 30 grados por cada carbono adicional, excepto para los homólogos muy pequeños. Las ramificaciones bajan el punto de ebullición. La polaridad de la molécula depende de la estereoquímica del alqueno. En los isómeros geométricos, el isómero Cis, por ser más polar y acomodarse más perfectamente en el retículo cristalino, generalmente presenta punto de ebullición más elevado y punto de fusión menor que el isómero Trans.
- 6. Propiedades Químicas de los alquenos: Los alquenos no se pueden catalogar como ácidos pero sus propiedades ácidas son un millón de veces mayores que las de los alcanos. Acidez El carbono alquenílico tiene mayor acidez frente a los alcanos, debido también a la polaridad del enlace. Este hecho se explica fácilmente considerando que, al desprenderse un electrón de la molécula, queda una carga negativa. Síntesis. Los métodos más utilizados para la síntesis de los alquenos son la deshidrogenación, deshalogenación ,deshidratación y deshidrohalogenación, siendo estos dos últimos los más importantes. Todos ellos se basan en reacciones de eliminación que siguen el siguiente esquema general: Y,Z pueden ser iguales ,por ejemplo en la deshidrogenación y en la deshalogenación. Y,Z también pueden ser diferentes como en la deshidratación y en la deshidrogenohalogenación.
- 7. H ID R O C A R B U R O S C O N T R IP L E S E N L A C E S : A L Q U IN O S • La nomenclatura de los alquinos se rige por reglas análogas a las de los alquenos. Solo hay que cambiar el sufijo − eno, por − ino CH ≡ C − CH2 − CH3 1−butino 1 2 3 4 5 6 CH ≡ CH CH ≡ C − CH2 − C ≡ C − CH3 etino 1,4−hexadiino 1 2 3 4 5 6 CH ≡ C − C ≡ C − C ≡ CH 1,3,5−hexatriino 7
- 8. Grupo Hibridación del Geometría del Fórmula Global Nomenclatura Funcional C C Alquino sp lineal CnH2n-2 R-ino Propiedades físicas Son insolubles en agua, pero bastante solubles en disolventes orgánicos usuales y de baja polaridad: ligroína, éter, benceno, tetracloruro de carbono. Son menos densos que el agua y sus puntos de ebullición muestran el aumento usual con el incremento del número de carbonos y el efecto habitual de ramificación de las cadenas. Los puntos de ebullición son casi los mismos que para los alcanos o alquenos con el mismo esqueleto carbonado. A medida que aumenta el peso molecular aumentan la densidad, el punto de fusión y el punto de ebullición. Propiedades químicas Acidez del hidrógeno terminal En algunas reacciones (frente a bases fuertes) actúan como ácidos débiles pues el hidrógeno terminal presenta cierta acidez. Se forman acetiluros (base conjugada del alquino)que son buenos nucleófilos y dan mecanismos de sustitución nucleófila con los reactivos adecuados.
- 9. Propiedades químicas Las reacciones más frecuentes son las de adición: de hidrógeno, halógeno, agua, etc. En estas reacciones se rompe el triple enlace y se forman enlaces de menor polaridad: dobles o sencillos. Hidrogenación de alquinos Los alquinos pueden ser hidrogenados para dar los correspondientes cis-alquenos (doble enlace) tratándolos con hidrógeno en presencia de un catalizador de paladio sobre sulfato de bario. HC≡CH + H2 → CH2=CH2 + H2 → CH3-CH3 Halogenación Dependiendo de las condiciones y de la cantidad añadida de halógeno (flúor, F2; cloro, Cl2; bromo, Br2...), se puede obtener derivados halogenados del alqueno o del alcano correspondiente. HC≡CH + Br2 → HCBr=CHBr HC≡CH + 2 Br2 → HCBr2-CHBr2 Hidrohalogenación, hidratación, etc. El triple enlace también puede adicionar halogenuros de hidrógeno, agua, alcohol, etc., con formación de enlaces dobles o sencillos. En general se sigue la regla de Markovnikov. HC≡CH + H-X → CH2=CHX donde X = F, Cl, Br... HC≡CH + H2O → CHOH=CH2
- 10. H ID R O C A R B U R O S C ÍC L IC O S • También llamados hidrocarburos alicíclicos. Se nombran anteponiendo el prefijo ciclo− al nombre del hidrocarburo de cadena lineal de igual número de átomos de C 1 CH2 − CH2 CH = 2 CH2 − CH2 5 CH2 CH ciclobutano CH CH 4 3 1,3−ciclopentadieno CH = CH CH2 CH2 CH2 − CH2 ciclohexeno 10
- 11. AROMÁTICOS Grupo Funcional Hibridación del C Geometría del C Nomenclatura Areno (Aromático) sp2 trigonal plana ......-eno PROPIEDADES FISICAS DE LOS HIDROCARBUROS AROMATICOS Los que solo contienen un anillo bencénico, generalmente son líquidos, en tanto que los aromáticos condensados casi siempre son sólidos. Todos ellos son insolubles en agua, pero son solubles en solventes orgánicos. PROPIEDADES QUÍMICAS DE LOS HIDROCARBUROS AROMATICOS Las reacciones que distinguen al benceno y a otros hidrocarburos aromáticos de los alquenos son las reacciones de sustitución electrofílica fácilmente controlables. La ecuación global para el benceno es:
- 12. PROPIEDADES QUIMICAS La sustitución aromática puede seguir tres caminos; electrofílico, nucleofílico y de radicales libres. Las reacciones de sustitución aromáticas más corrientes son las originadas por reactivos electrofílicos. Su capacidad para actuar como un dador de electrones se debe a la polarización. Halogenación El cloro y el bromo dan derivados de sustitución que recibe el nombre de haluros de arilo. C6H6 + Cl2 C6H5Cl + HCl Clorobenceno C6H6 + Br2 C6H5Br + HBr Bromobenceno Sulfonación Cuando los hidrocarburos bencénicos se tratan con ácido sulfúrico fumante H2SO4 + SO3 se forman compuestos característicos que reciben el nombre de ácidos sulfónicos. En realidad, se cree que el agente activo es el SO3 C6H6 + HOSO3H C6H5SO3H + H2O Ácido benceno sulfónico
- 13. Nitración El ácido nítrico fumante produce derivados nitrados, por sustitución. El ácido sulfúrico absorbe el agua producida en la nitración y así se evita la reacción inversa: C6H6 + HONO2 C6H5NO2 + H2O Nitro –benceno Combustión. 2 C6H6 +15 O2 12CO2 + 6H2O Hidrogenación El núcleo Bencénico, por catálisis, fija seis átomos de hidrógeno, formando el ciclohexano, manteniendo así la estructura de la cadena cerrada. C6H6 + 3H2 C6H12 Síntesis de Friedel y Crafts, Alquilación El benceno reacciona con los haluros de alquilo, en presencia de Cloruro de aluminio anhidro como catalizador, formando homólogos. C6H6 + CH3Cl C6H5CH3 + HCl Tolueno .
