Quimica
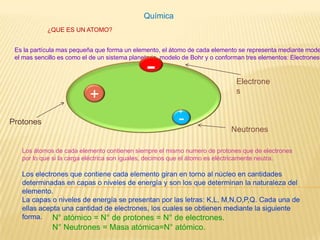
- 1. Química ¿QUE ES UN ATOMO? Es la partícula mas pequeña que forma un elemento, el átomo de cada elemento se representa mediante modelos atómicos,el mas sencillo es como el de un sistema planetario, modelo de Bohr y o conforman tres elementos: Electrones, y Neutrones Protones. - Electrones + + - Protones Neutrones Los átomos de cada elemento contienen siempre el mismo numero de protones que de electrones por lo que si la carga eléctrica son iguales, decimos que el átomo es eléctricamente neutra. Los electrones que contiene cada elemento giran en torno al núcleo en cantidades determinadas en capas o niveles de energía y son los que determinan la naturaleza del elemento.La capas o niveles de energía se presentan por las letras: K,L, M,N,O,P,Q. Cada una de ellas acepta una cantidad de electrones, los cuales se obtienen mediante la siguiente forma. N° atómico = N° de protones = N° de electrones.N° Neutrones = Masa atómica=N° atómico.
- 2. “Como obtener la masa molecular” El mol es el peso atómico de un elemento, expresado en gramos.Es la mas molecular(M.m) de un compuesto expresado en gramos. Para obtener la M.m de un compuesto. Primero, debes colocar el compuesto. H2O2 Después multiplica los átomos de cada elemento por su numero atómico. 2 H – 2 * 1= 22 O - 2 * 16 =32 34 Al final sumas las cantidades y el resultado es la masa molecular. M.M H2O2 = 34 gramos.
- 3. “Reacciones químicas” Una reacción química es un proceso mediante el cual, elementos y compuestos se unen para formar una o mas sustancias con diferentes características.Ejemplo: C + O 2CO2 Una ecuación química consta de dos partes: Los Reactivos y lo Productos. Simbología en una ecuación y sus partes. 2 Na + 2HCL2NaCl + H2 + Productos Reactivos Simbología Indica produce o se transforma en (reacción irreversible). Se desprende o se transforma en (Reacción irreversible). Indica la formación de un precipitado La reacción es reversible. Significa calor. Si se coloca en los productos significa que libera calor, si se coloca en los reactivos o sobre la flecha que produce, nos indica que el calor se gana o absorbe.
- 4. “Ley de la conservación de la materia” Esta ley propuesta por Antonio Lavoisier establece, “La materia no se crea, no se destruye solo se transforma” Como se balancea un ecuación desde el punto de vista QUIMICO H2 SO4+ Na OH Na2SO4 + H2O Escribir completa la ecuación. 3 H =2 H1 S =1 S5 O =5 O1 Na=2Na Determinar cuantos átomos están presentes en ambos lados de la ecuación. Analizar cuantos átomos le hacen falta a la ecuación en ambos lados. Agregar coeficientes estequiometricos que permitan tener igualdad de átomos en la ecuación. H 2 so4 + 2 Na OH NaSO4 +2 H2O
- 5. “Medición de la materia” Algunas propiedades de la materia que se pueden medir son la masa, el volumen y la densidad. La masa y sus unidades La masa es únicamente la cantidad de la materia contenida en un cuerpo y esto no debe confundirse con el peso ya que el peso es la atracción que ejerce la tierra sobre ese cuerpo.La masa es una de las medidas mas importantes de la materia y se usa en muchas situaciones. Diferentes unidades la misma masa Para realizar conversiones se utiliza el sistema de factores de conversión, que son relaciones de unidades equivalentes. ProcedimientoEjemplo:10 metros cuantos centímetro son.10Mts a cm:1 Mts= 100 cm. 1 mtr o 100cm100cm 1mt 10 mtrs 100cm 1 mtr 10* 100 cm= 1000 cm10mtrs =1000cm.
