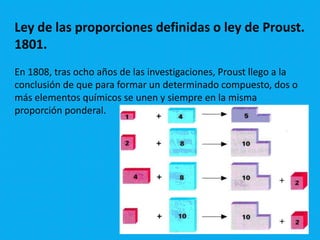
Este documento presenta un resumen de cuatro importantes leyes ponderales: 1) La ley de conservación de la masa establecida por Lavoisier en 1789, la cual establece que la masa total se conserva en una reacción química. 2) La ley de las proporciones definidas de Proust de 1801, la cual establece que los elementos se unen en proporciones ponderales fijas. 3) La ley de las proporciones múltiples de Dalton de 1803, la cual establece que los elementos se combinan en relaciones de