Tabla periódica con los número de oxidación de los elementos más comunes
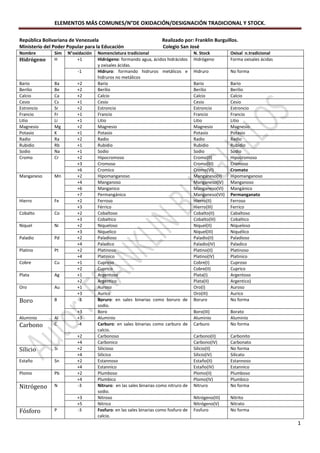
- 1. ELEMENTOS MÁS COMUNES/N°DE OXIDACIÓN/DESIGNACIÓN TRADICIONAL Y STOCK. 1 República Bolivariana de Venezuela Realizado por: Franklin Burguillos. Ministerio del Poder Popular para la Educación Colegio San José Nombre Sim N°oxidación Nomenclatura tradicional N. Stock Oxisal n.tradicional Hidrógeno H +1 Hidrógeno: formando agua, ácidos hidrácidos y oxisales ácidas. Hidrógeno Forma oxisales ácidas -1 Hidruro: formando hidruros metálicos e hidruros no metálicos Hidruro No forma Bario Ba +2 Bario Bario Bario Berilio Be +2 Berilio Berilio Berilio Calcio Ca +2 Calcio Calcio Calcio Cesio Cs +1 Cesio Cesio Cesio Estroncio Sr +2 Estroncio Estroncio Estroncio Francio Fr +1 Francio Francio Francio Litio Li +1 Litio Litio Litio Magnesio Mg +2 Magnesio Magnesio Magnesio Potasio K +1 Potasio Potasio Potasio Radio Ra +2 Radio Radio Radio Rubidio Rb +1 Rubidio Rubidio Rubidio Sodio Na +1 Sodio Sodio Sodio Cromo Cr +2 Hipocromoso Cromo(II) Hipocromoso +3 Cromoso Cromo(III) Cromoso +6 Cromico Cromo(VI) Cromato Manganeso Mn +2 Hipomanganoso Manganeso(II) Hipomanganoso +4 Manganoso Manganeso(IV) Manganoso +6 Manganico Manganeso(VI) Mangánico +7 Permangánico Manganeso(VII) Permanganato Hierro Fe +2 Ferroso Hierro(II) Ferroso +3 Férrico Hierro(III) Ferrico Cobalto Co +2 Cobaltoso Cobalto(II) Cabaltoso +3 Cobaltico Cobalto(III) Cobaltico Niquel Ni +2 Niqueloso Niquel(II) Niqueloso +3 Niquelico Niquel(III) Niquélico Paladio Pd +2 Paladioso Paladio(II) Paladioso +4 Paladico Paladio(IV) Paladico Platino Pt +2 Platinoso Platino(II) Platinoso +4 Platinico Platino(IV) Platinico Cobre Cu +1 Cuproso Cobre(I) Cuproso +2 Cuprico Cobre(II) Cuprico Plata Ag +1 Argentoso Plata(I) Argentoso +2 Argentico Plata(II) Argentico) Oro Au +1 Auroso Oro(I) Auroso +3 Aurico Oro(III) Aurico Boro B -3 Boruro: en sales binarias como boruro de sodio. Boruro No forma +3 Boro Boro(III) Borato Aluminio Al +3 Aluminio Aluminio Aluminio Carbono C -4 Carburo: en sales binarias como carburo de calcio. Carburo No forma +2 Carbonoso Carbono(II) Carbonito +4 Carbonico Carbono(IV) Carbonato Silicio Si +2 Silicioso Silicio(II) No forma +4 Silicico Silicio(IV) Silicato Estaño Sn +2 Estannoso Estaño(II) Estannoso +4 Estannico Estaño(IV) Estannico Plomo Pb +2 Plumboso Plomo(II) Plumboso +4 Plumbico Plomo(IV) Plumbico Nitrógeno N -3 Nitruro: en las sales binarias como nitruro de sodio. Nitruro No forma +3 Nitroso Nitrógeno(III) Nitrito +5 Nitrico Nitrógeno(V) Nitrato Fósforo P -3 Fosfuro: en las sales binarias como fosfuro de calcio. Fosfuro No forma
- 2. ELEMENTOS MÁS COMUNES/N°DE OXIDACIÓN/DESIGNACIÓN TRADICIONAL Y STOCK. 2 +3 Fosforoso Fósforo(III) Fosfito +5 Fosforico Fosforo(V) Fosfato Arsenico As -3 Arsenuro: en las sales binarias como arseniuro de sodio Arsenuro No forma +3 Arsenoso Arsenico(III) Arsenito +5 Arsenico Arsenico(V) Arsenato Antimonio Sb -3 Antimonuro: en las sales binarias como antimonuro de sodio. Antimoniuro No forma +3 Antimonoso Antimonio(III) Antimonito +5 Antimonico Antimonio(V) Antimonato Bismuto Bi -3 Bismuturo: en las sales binarias como bismuturo de sodio. Bismuturo No forma +3 Bismutoso Bismuto(III) Bismutito +5 Bismutico Bismuto(V) Bismutato Oxígeno O -2 Óxido Cuando está unido con metales exclusivamente Anhídrido Cuando está unido exclusivamente a un no metal en la nomenclatura tradicional Óxido Siempre el no metal estará unido al oxígeno. El no metal llevará terminación “ITO” o “ATO” dependiendo de su terminación “OSO” o “ICO” en el oxácido correspondiente. Azufre S -2 Sulfuro: en los ácidos hidrácidos y sales binarias neutras o ácidas. Sulfuro No forma +2 Hiposulfuroso Azufre(II) Hiposulfito +4 Sulfuroso Azufre(IV) Sulfito +6 Sulfurico Azufre(VI) Sulfato Selenio Se -2 Selenuro: en los ácidos hidrácidos y sales binarias Seleniuro No forma +2 Hiposelenoso Selenio(II) Hiposelenito +4 Selenoso Selenio(IV) Selenito +6 Selenico Selenio(VI) Selenato Telurio Te -2 Telururo: en los ácidos hidrácidos y sales binarias Telururo No forma +2 Hipoteluroso Telurio(II) Hipotelurito +4 Teluroso Telurio(IV) Telurito +6 Telurico Telurio(VI) Telurato Flúor F -1 Fluoruro: en los ácidos hidrácidos y sales binarias Fluoruro No forma Cloro Cl -1 Cloruro: en los ácidos hidrácidos y sales binarias Cloruro No forma +1 Hipocloroso Cloro(I) Hipoclorito +3 Cloroso Cloro(III) Clorito +5 Clorico Cloro(V) Clorato +7 Perclorico Cloro(VII) Perclorato Bromo Br -1 Bromuro: en los ácidos hidrácidos y sales binarias Bromuro No forma +1 Hipobromoso Bromo(I) Hipobromito +3 Bromoso Bromo(III) Bromito +5 Bromico Bromo(V) Bromato +7 Perbromico Bromo(VII) Perbromato Yodo I -1 Yoduro: en los ácidos hidrácidos y sales binarias Yoduro No forma +1 Hipoyodoso Yodo(I) Hipoyodito +3 Yodoso Yodo(III) Yodito +5 Yodico Yodo(V) Yodato +7 Periodico Yodo(VII) Peryadato Mercurio Hg +1 Mercurioso Mercurio(I) Mercurioso +2 Mercurico Mercurio(II) Mercurico Zinc Zn +2 Zinc Zinc Zinc Obs: metaloides y no metales, sus nombres aparecen más grandes y resaltados en negrita.
- 3. ELEMENTOS MÁS COMUNES/N°DE OXIDACIÓN/DESIGNACIÓN TRADICIONAL Y STOCK. 3 En la nomenclatura estequiométrica se deben utilizar prefijos para indicar la atomicidad de cada elemento dentro de la molécula de una sustancia pura, a continuación se te presentan: Atomicidad Prefijo a emplear para nombrar la sustancia pura 1 Mono 2 Di 3 Tri 4 Tetra 5 Penta 6 Hexa 7 Hepta 8 Octa 9 Nona 10 Deca Formulción de compuestos binarios: formados por dos átomos distintos. 1) Óxidos básicos u óxidos metálicos: metal unido a oxígeno Metal2On donde; n= n° de oxidación del metal. 2) Óxidos ácidos u anhídridos: no metal unido a oxígenono metal2On donde; n=n° de oxidación del no metal. 3) Hidruros metálicos: metal unido a hidrógeno(-1) metal Hn donde; n = n° de oxidación del metal. 4) Hidruros no metálicos: no metal unido a hidrógeno(-1) no metal Hn donde; n=n° de oxidación del no metal. 5) Ácidos hidrácidos: hidrógeno(+1) unido a no metal (flúor(-1), cloro(-1), bromo(-1), yodo(-1), azufre(-2), selelenio(-2) o telurio(-2)) 6) Sales haloideas: metal unido a halógeno(flúor(-1), cloro(-1), bromo(-1) o yodo(-1)) metalxhalógenon donde; x=-1 y n= n° de oxidación del metal. 7) Sales de azufre: metal unido a azufre metalxSn donde; x=-2 y n=n° de oxidación del metal. Formulación de compuestos ternarios: formados por tres átomos distintos. 1) Hidróxidos: óxido básico + H2O metal(OH)n donde; n= número de oxidación del metal. 2) Ácidos oxácidos: óxido ácido + H2O hidrógeno + no metal + oxígeno. 3) Oxisal neutra: hidróxido + ácido oxácido (metal+no metal+oxígeno) + H2O Formulación de compuestos cuaternarios: formados por cuatro átomos distintos. 0xisales ácidas: sustitución parcial de los hidrógenos de un ácido oxácido diprótico o triprótico por un metal metal+hidrógeno+no metal+ oxígeno. oxisal Ácido oxácido Algunos ejemplos pueden ser: I) BaO monóxido de monobario II) Na2O monóxido de disodio III) Al2O3 trióxido de dialuminio IV) Cl2O5 pentóxido de dicloro V) Br2O7 heptóxido de dibromo VI) SO3 trióxido de monoazufre
- 4. ELEMENTOS MÁS COMUNES/N°DE OXIDACIÓN/DESIGNACIÓN TRADICIONAL Y STOCK. 4 Repasemos… Verdadero o falso. Encierra en un círculo la V o F. Justifica si es falsa 1. Los óxidos son compuestos formados al unir un elemento con el oxígeno V F ______________________________________________________________________________________ 2. Al combinar un metal con el oxígeno se forma un óxido ácido V F __________________________________________________________________________________ 3. Al unir un no metal con el oxígeno se forma un anhídrido V F __________________________________________________________________________________ 4. Si a un óxido básico se le añade agua, se forma hidróxido V F __________________________________________________________________________________ 5. Un óxido ácido se forma entre un no metal y oxígeno V F __________________________________________________________________________________ 6. Al agregarle agua a un óxido ácido se forma un oxácido V F __________________________________________________________________________________ 7. Si un metal está unido al hidrógeno se forma un hidruro no metálico V F __________________________________________________________________________________ 8. La reacción entre un hidróxido y oxácido forma Oxisal más agua V F __________________________________________________________________________________ 9. La sustitución parcial de los hidrógenos de un oxácido monoprótico forma una Oxisal neutra V F __________________________________________________________________________________ 10. Las oxisales ácidas se obtienen al sustituir los hidrógenos de un oxácido diprótico o triprótico V F __________________________________________________________________________________ 11. Al unir el hidrógeno con un no metal como el flúor o cloro forma una sal haloidea V F __________________________________________________________________________________ 12. Un óxido básico más agua forma un oxácido V F __________________________________________________________________________________ 13. Un óxido ácido más agua forma un hidróxido V F __________________________________________________________________________________ 14. Un no metal combinado con el hidrógeno(-1) forma un hidruro no metálico V F _________________________________________________________________________________ 15. Si se combina el azufre(-2) con un metal forma una sal binaria V F _________________________________________________________________________________ 16. Si el hidrógeno forma una hidruro trabaja con número de oxidación -1 V F _________________________________________________________________________________ 17. Si el azufre se combina con un metal, lo hace con número de oxidación +2 V F _________________________________________________________________________________ 18. En los óxidos, el oxígeno trabaja con número de oxidación -1 V F _________________________________________________________________________________ 19. Las terminaciones OSO e ICO se utilizan en la nomenclatura STOCK V F _________________________________________________________________________________ 20. El mercurio es el único metal líquido V F __________________________________________________________________________________ 21. Los oxácidos están constituidos por hidrógeno+nometal+oxígeno V F _________________________________________________________________________________ 22. Los hidróxidos están formados por metal+oxígeno+hidrógeno V F __________________________________________________________________________________ 23. Los hidrácidos están formados por hidrógeno+(flúor, bromo, yodo o cloro) V F _________________________________________________________________________________ 24. Los óxidos básico están constituidos por metal+oxígeno V F _________________________________________________________________________________ 25. En los hidruros el hidrógeno trabaja con número de oxidación -1 V F __________________________________________________________________________________
