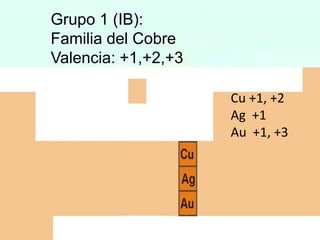
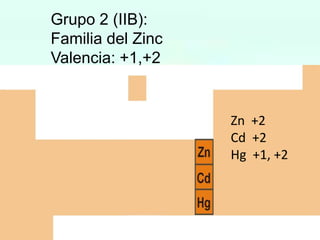
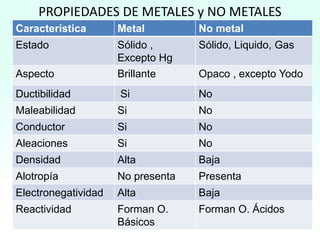
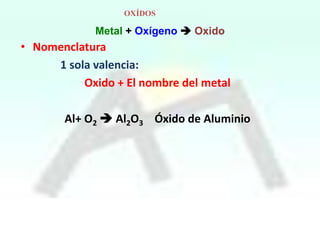
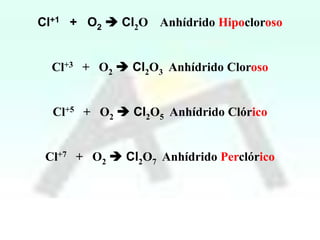
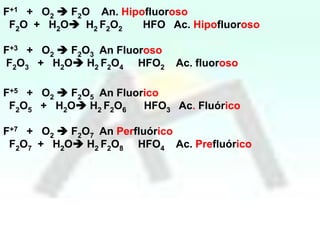
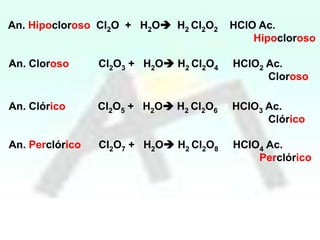
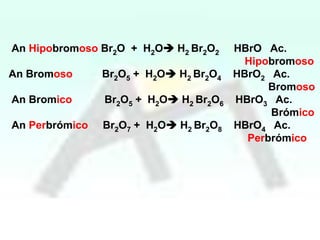
HBrO Ac.
Hipobromoso
Br2O3 + H2O H2 Br2O4 HBrO2 Ac. Bromoso
An Bromico
HBrO3 Ac.
Bromico
Br2O5 + H2O H2 Br2O6
An Perbrómico Br2O7 + H2O H2 Br2O8
HBrO4 Ac.
Perbrómico
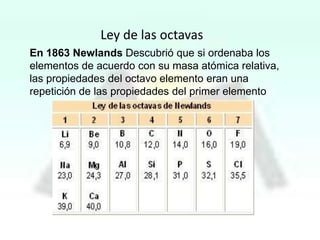
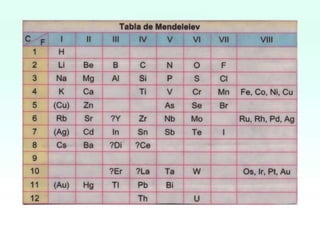
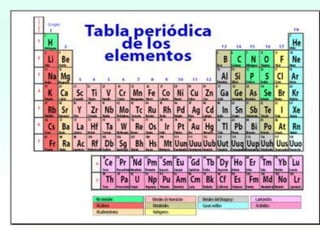
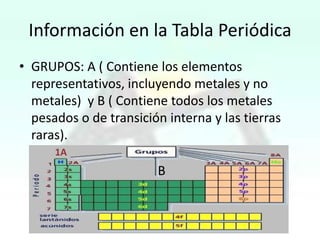
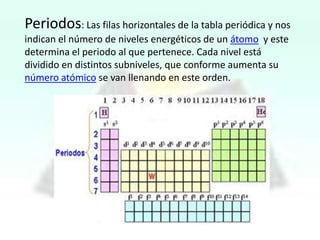
El documento presenta información sobre la tabla periódica, incluyendo sus antecedentes históricos,