El documento describe el concepto de equilibrio químico, indicando que ocurre cuando las concentraciones de los reactivos y productos permanecen constantes con el tiempo. Explica que la constante de equilibrio (Kc) representa la relación entre las concentraciones de reactivos y productos en el equilibrio. Finalmente, señala que factores como cambios en la concentración, presión o temperatura afectan la posición del equilibrio de acuerdo al principio de Le Chatelier.




![VARIACIÓN DE LA CONCENTRACIÓN CON EL TIEMPO
Equilibrio químico
Concentraciones (mol/l)
[HI]
[I2]
[H2]
Tiempo (s)](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-5-320.jpg)

![CONSTANTE DE EQUILIBRIO (KC)
La constante de equilibrio es la relación que se establece
entre las concentraciones de reactivos y productos cuando
se alcanza el estado de equilibrio.
Deducimos su expresión:
Sea la siguiente reacción reversible
a A(g) + b B(g) ⇌ c C(g) + d D(g)
Si tiene lugar mediante un mecanismo de un solo paso
VD= KD[A]a[B]b y VI= KI[C]c[D]d
En el equilibrio: VD= VI
igualando se tiene : [C ]c [D]d
Kc
[ A]a [B]b](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-7-320.jpg)
![Ejemplo: Escribir las expresiones de KC para los siguientes
equilibrios químicos:
H2(g) + I2(g) ⇌ 2HI(g) [HI ]2
Kc
[H2 ] [I2 ]
[SO3 ]2
2SO2(g) + O2(g) ⇌ 2SO3(g) KC
[SO2 ]2 [O2 ]
[NO2 ]2
N2O4(g) ⇌ 2NO2(g) Kc
[N2O4 ]](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-8-320.jpg)
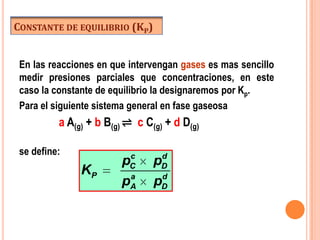
![RELACIÓN ENTRE KP Y KC
Para la reacción: a A(g) + b B(g) ⇌ c C(g) + d D(g)
c d
pC pD [C ]c (RT )c [D ]d (RT )d
KP a d
pA pD [ A]a (RT )a [B]b (RT )b
[C ]c [D ]d (RT )c (RT )d ng
KC (RT )
[ A]a [B]b (RT )a (RT )b
por lo tanto: n
KP KC (RT )
donde: ∆n= (c+d) – (a+b)
R= 0,082 atm.L / mol.K
T= temperatura absoluta (K)](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-10-320.jpg)

![TIPOS DE EQUILIBRIO
EQUILIBRIO HOMOGÉNEO
Son aquellos sistemas donde los reactantes y productos se
encuentran en una misma fase o en un mismo estado físico
Ejemplo
1N2(g) + 3H2(g) ⇌ 2NH3(g) KC=[NH3]2 / [N2].[H2]3
EQUILIBRIO HETEROGÉNEO
Son sistemas donde las sustancias se encuentran en más de una
fase o más de un estado físico
Ejemplo
CaCO3(s) + calor ⇌ CaO(s) + CO2(g) KC=[CO2]](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-12-320.jpg)





![VARIACIONES EN EL EQUILIBRIO
[reactivos] ↑
[reactivos] ↓
[productos] ↑
[productos] ↓
T ↑ (exotérmicas)
T ↑ (endotérmicas)
T ↓ (exotérmicas)
T ↓ (endotérmicas)
p ↑ Hacia donde menos nº moles de gases
p ↓ Hacia donde más nº moles de gases](https://image.slidesharecdn.com/clasedeequilibrioquimico-111022181932-phpapp02/85/Clase-de-equilibrio-quimico-18-320.jpg)