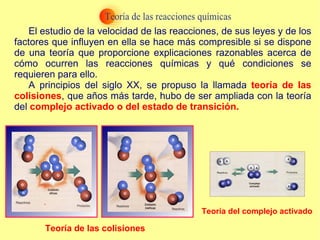
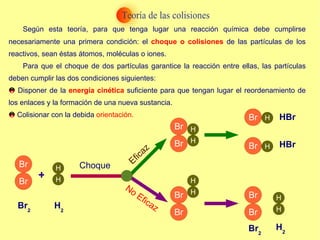
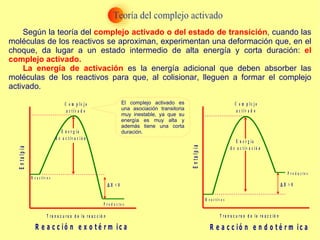
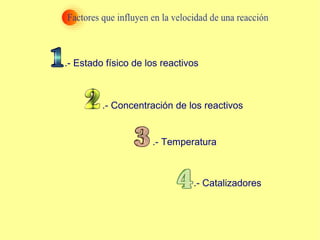
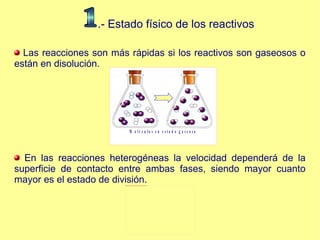
El documento trata sobre la cinética química, incluyendo la expresión de la velocidad de reacción, la ecuación y constante de velocidad, los órdenes de reacción, los mecanismos de reacción, las teorías sobre cómo ocurren las reacciones químicas, y los factores que influyen en la velocidad de una reacción como la concentración de los reactivos, la temperatura y los catalizadores.





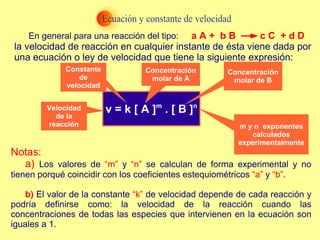
![En la expresión: v = k [ A ] m . [ B ] n se denomina: Orden Global de la reacción: A la suma de los exponentes a los que están elevadas las concentraciones de los reactivos en la ecuación de velocidad. Es decir el valor de “m + n” Orden de una reacción respecto a un reactivo: Es el exponente al que se eleva la concentración de éste en la ecuación de velocidad. En este caso la reacción sería de orden “m” respecto al reactivo A y de orden “n” respecto al reactivo B Ejemplo: Determina los órdenes global y parciales de la siguiente reacción: Br 2 (g) + H 2 (g) => 2 HBr (g) v = k [Br 2 ] 1/2 X [H 2 ] Solución: Reacción de orden 3/2 ( 1 + ½ ) Reacción de primer orden respecto al H 2 y de orden ½ respecto al Br 2](https://image.slidesharecdn.com/cineticaquimica-100225122405-phpapp02/85/Cinetica-Quimica-7-320.jpg)
![La determinación de la ecuación de velocidad consiste en medir la velocidad de la reacción manteniendo constantes las concentraciones de todos los reactivos excepto la de uno y observar cómo afecta la variación de éste al valor de la velocidad. Si por ejemplo, duplicamos la concentración de un reactivo y la velocidad también se duplica, diremos que el orden respecto a ese reactivo es 1; pero si la velocidad se hace cuatro veces mayor, diremos que el orden respecto a ese reactivo es 2 etc... Ejemplo: Determina el orden de reacción : a A + b B => c C utilizando los datos de la siguiente tabla: Solución: v = k [A] x [B] 2](https://image.slidesharecdn.com/cineticaquimica-100225122405-phpapp02/85/Cinetica-Quimica-8-320.jpg)