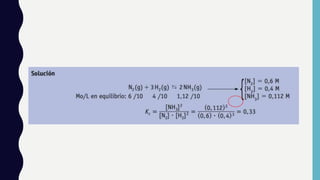
Las reacciones en equilibrio son dinámicas, donde los reactivos se transforman en productos y viceversa a la misma velocidad, alcanzando un estado de equilibrio. La constante de equilibrio (Kc) refleja la relación entre las concentraciones de reactivos y productos al equilibrio, que depende de la temperatura y puede ser influenciada por cambios en entalpía y entropía. La ecuación de Van't Hoff describe cómo la temperatura afecta la constante de equilibrio, indicando que un aumento de temperatura favorece reacciones endotérmicas, mientras que la disminución favorece las exotérmicas.












![• Kc = [CO2]; Kp=PCO2](https://image.slidesharecdn.com/equilibrioquimico-190425234545/85/Equilibrio-quimico-constante-de-equilibrio-14-320.jpg)
![CONSTANTE DE EQUILIBRIO EN
FUNCION DE CONCENTRACIONES
MOLARES (KC)
• EL PRODUCTO DE LAS CONCENTRACIONES DE LOS PRODUCTOS ELEVADA A SUS
COEFICIENTES ESTEQUIOMETRICOS DIVIDIDO ENTRE LAS CONCENTRACIONES DE LOS
REACTIVOS EN EL EQUILIBRIO ELEVADA A LOS COEFICIENTES ESTEQUIOMETRICOS
• Siendo [ ] la concentración Molar de cada una de las sustancias en equilibrio
• En Kc solo entran en juego los gases y las disoluciones acuosas
• Kc es una constante que solo depende de la temperatura
• siendo las concentraciones medidas en el equilibrio (no confundir con las concentraciones iniciales
de reactivos y productos).
• Se denomina constante de equilibrio, porque se observa que dicho valor es constante (dentro un
mismo equilibrio) si se parte de cualquier concentración inicial de reactivo o producto.](https://image.slidesharecdn.com/equilibrioquimico-190425234545/85/Equilibrio-quimico-constante-de-equilibrio-15-320.jpg)


![TENEMOS UN RECIPIENTE EN L A QUE TENDREMOS TODOS LOS GASES ( L A P RESIÓN SE VIENE DANDO
POR EL NÚMERO DE CHOQUES DE LOS GASES CON EL RECIPIENTE)
A PARTIR DE CONOCER L AS
PRESIONES PARCIALES
• PT= PA + PB + PC + PD
• PV= n° RT
PA =
𝑛°𝐴 .𝑅.𝑇
𝑉
PA= XA . PT
XA =
𝑛𝐴
𝑛𝑇
A PARTIR DE L AS REL ACIONES KC
Y KP
• kp=
(𝑃𝐶) 𝑐 (𝑃𝐷) 𝑑
(𝑃𝐴) 𝑎 (𝑃𝐵) 𝑏 se relaciona con la precion y
las concentraciones
• PCV= n°c RT
• PC =
𝑛°𝐶
𝑉
𝑅𝑇 es una conc.
PC= ( 𝐶 𝑅𝑇) 𝐶
𝑘𝑝 =
( 𝐶 𝑅𝑇) 𝐶
( 𝐷 𝑅𝑇) 𝑑
( 𝐴 𝑅𝑇) 𝑎( 𝐵 𝑅𝑇) 𝑏
Se usara la potencia del producto: EJ:
𝑘𝑝 =
[𝐶] 𝐶
(𝑅𝑇) 𝐶
[𝐷] 𝑑
(𝑅𝑇) 𝑑
[𝐴] 𝑎(𝑅𝑇) 𝑎 [𝐵] 𝑏(𝑅𝑇) 𝑏
Kp=
(𝐶) 𝑐 (𝐷) 𝑑
𝐴 𝑎(𝐵) 𝑏 𝑅𝑇 𝐶+𝑑−𝑎−𝑏
Kp= KC (𝑅𝑇) 𝑐+𝑑−(𝑎+𝑏)
Kp=KC(RT)▵𝑁 𝑔𝑎𝑠𝑒𝑜𝑠𝑜
▵ 𝑁= sumar c+d y restar b y aAa + Bb Cc + Dd](https://image.slidesharecdn.com/equilibrioquimico-190425234545/85/Equilibrio-quimico-constante-de-equilibrio-18-320.jpg)







