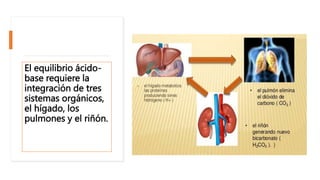
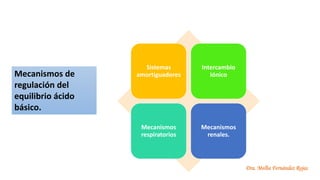
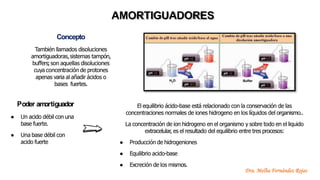
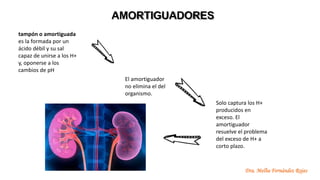
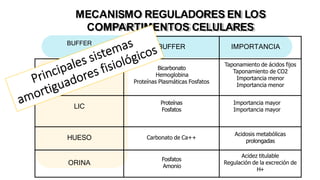
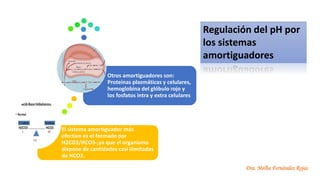
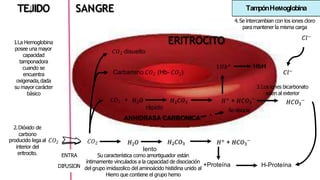
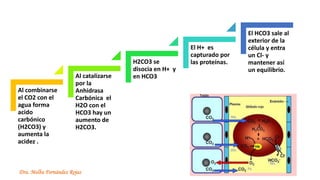
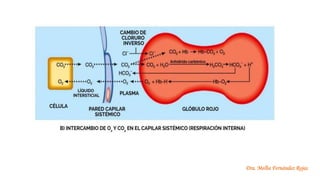
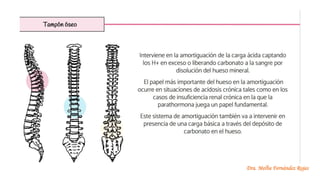
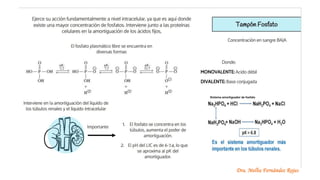
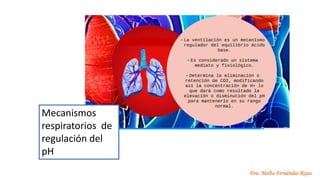
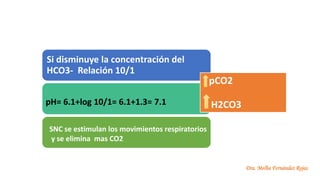
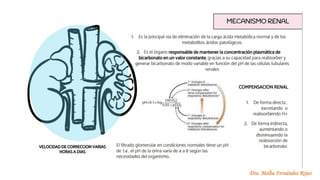
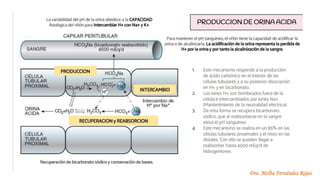
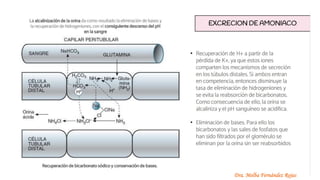
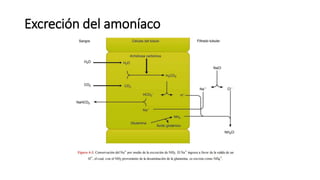
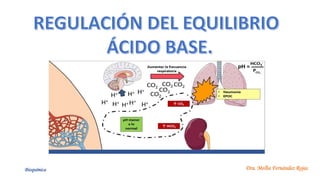
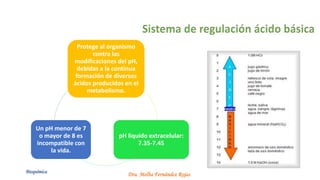
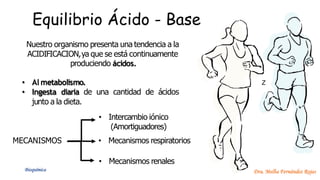
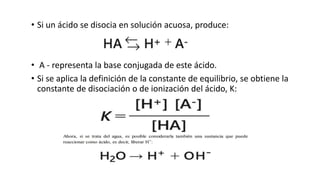
El documento describe los mecanismos de regulación del equilibrio ácido-base en el organismo. Explica que se mantienen concentraciones estrechas de iones hidrogeno a través de sistemas amortiguadores, intercambio iónico, mecanismos respiratorios y renales. El principal sistema amortiguador es el tampón carbónico formado por H2CO3 e HCO3-, el cual ayuda a neutralizar ácidos producidos en el metabolismo.

![Dra. Melba Fernández Rojas
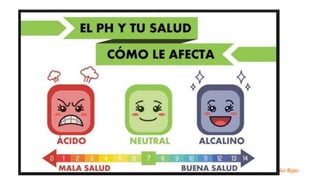
La concentración
sanguínea de
hidrogeniones
[H+] se mantiene
dentro de
estrechos límites
en individuos
sanos.
Las
concentraciones
normales 35 y 45
nmoI/L
Los valores
superiores a 120
nmol/L o
inferiores a 20
nmol/L requieren
tratamiento
urgente.
No son
compatibles con la
vida.
Bioquímica](https://image.slidesharecdn.com/01-230901150447-136c6b9c/85/01-REGULACION-DEL-EQUILIBRIO-ACIDO-BASE-pptx-3-320.jpg)

![Dra. Melba Fernández Rojas
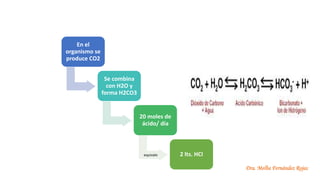
Los hidrogeniones se producen
en el organismo del
metabolismo de la oxidación
de los aminoácidos de las
proteínas de la dieta.
Se producen 60 mmol de H+. Si esta
cantidad se distribuye por el líquido
extracelular la [H+] ascendería a 4
mmol/L, [100.000] veces superior a
la normal
En el metabolismo también se
produce CO2. Este gas se
comporta en disolución como
un ácido débil.
El CO2 producido, puede
alterar el equilibrio ácido-
base, en condiciones
normales es transportado
por la sangre hasta los
pulmones y eliminado al
respirar.
PRODUCCIÓN DE CO2](https://image.slidesharecdn.com/01-230901150447-136c6b9c/85/01-REGULACION-DEL-EQUILIBRIO-ACIDO-BASE-pptx-7-320.jpg)
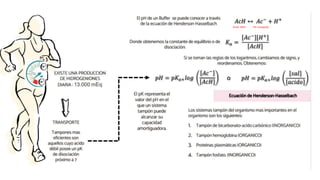
![Produccióndehidrogeniones
DIETA
METABOLISMO
PRODUCCION DE
HIDROGENIONES
LEC :Sangre arterial
7,45 ,venosa 7,35 ,
liquido intersticial 7,35
FISIOLOGICAMENTE
SE DISTINGUEN:
PRINCIPAL CAUSA
DE ALTERACION DEL
pH
Recordemos……..
ACIDO:Sustancia capazdeceder hidrogeniones.
BASE:Sustanciacapazde aceptar hidrogeniones
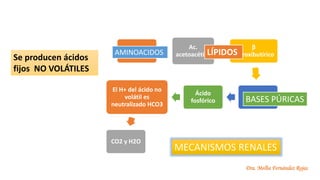
● Producto del catabolismo completo de proteínas: Los
aminoácidos azufrados (metionina y cisteína) que originan
sulfato y carbonatos.
● Degradación de Ácidos nucleicos y fosfolípidos que producen
fosfatos
LIC: [6.0 − 7.4 ]
Orina: [4,5 − 8,0]
HCl: [0.8]
● Ácidos volátiles:Subproducto del metabolismo de
la glucosa y son eliminados porla respiración .
● Ácidos no volátiles: Son ácidos fijos porque
forman parte de un sistema en el que ni ellos ni
sus formas disociadas en equilibrio tienen
características volátiles y sonlos queno se
eliminan en los pulmones sino porel riñón.
EJEMPLOS
𝐶𝑂2
Acido láctico
cetoácidos sulfúrico
clorhídrico fosfórico
Dra. Melba Fernández Rojas](https://image.slidesharecdn.com/01-230901150447-136c6b9c/85/01-REGULACION-DEL-EQUILIBRIO-ACIDO-BASE-pptx-11-320.jpg)