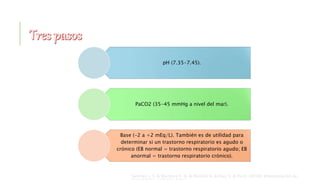
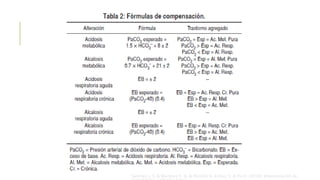
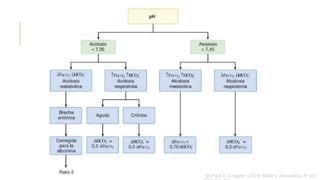
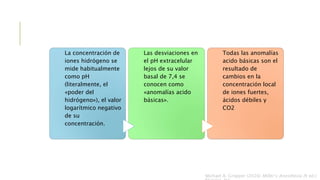
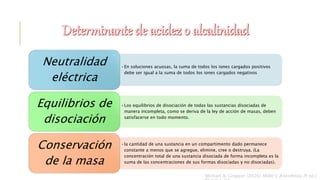
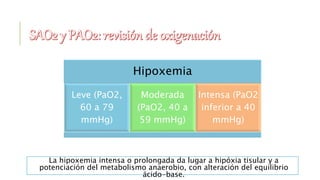
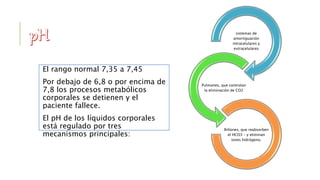
El documento discute los trastornos del equilibrio ácido-base. Explica que el pH, la PaCO2 y el HCO3- son los componentes clave evaluados. Describe las causas, características y mecanismos de compensación de la acidosis y alcalosis respiratoria y metabólica.

![Michael A. Gropper (2020) Miller’s Anesthesia (9 ed.)
Una solución se considera ácida si la
concentración de iones hidrógeno excede
la de los iones hidroxilo ([H+] > 1 × 10–7
mmol/l, [OH–] < 1 × 107 mmol/l).
Una solución se considera alcalina si la
concentración de iones hidroxilo excede
la concentración de iones hidrógeno.](https://image.slidesharecdn.com/1-230301034923-fe2e09f7/85/1-4-Gasometria-arterial-pptx-3-320.jpg)






![Basa en el principio de la electroneutralidad del plasma, que implica
que la suma de las cargas positivas o cationes (C) sea igual a la suma
de cargas negativas o aniones (A): (A = C = 155 mmol).
Brecha aniónica plasmática = [Na+–(HCO3-+Cl-)] = 12 ± 2 mmol/l.
Su cálculo se muestra especialmente útil en el diagnóstico de las
acidosis metabólicas simples o complejas.](https://image.slidesharecdn.com/1-230301034923-fe2e09f7/85/1-4-Gasometria-arterial-pptx-13-320.jpg)