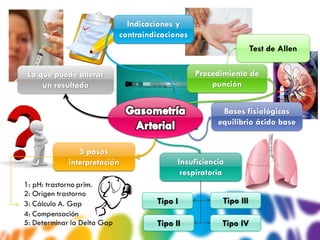
El documento proporciona una guía sobre la gasometría, incluyendo indicaciones, técnicas de toma de muestras, principios de equilibrio ácido-base y su interpretación. Se abordan diferentes tipos de insuficiencia respiratoria, sus causas y parámetros de medición necesarios para un diagnóstico adecuado. Además, se discuten errores comunes en la interpretación de resultados y condiciones que pueden afectar los resultados de la gasometría.



















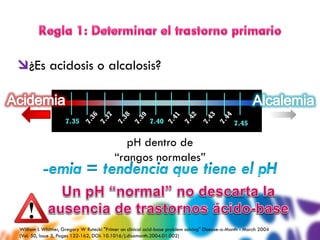



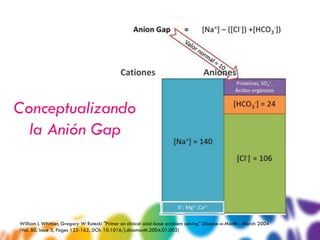











![ Regla 1: Acidemia (pH < 7.4)
pH 7.34
Regla 2: Metabólico (HCO3- : 16 mEQ)
pCO2 31 mmHg
Regla 3: A. Gap elevado
pO2 97 mmHg
(143 – [16 + 102])= 25 mEq AGap (recuérdalo)
HCO3- 16 mEq Un A.Gap >20 = ACIDOSIS
Na 143 mEq/L Regla 4: Compensación
K 3.8 mEq/L La acidosis metabólica se compensa con
Cl 102 mEq/L disminución del CO2
BUN 18 mg/dL PCO2 debe disminuir 1.3 por 1 mEq HCO3-
Cr 1.2 mg/dL 1.3 x (25-16) = 11 mEq debe disminuir el PCO2
Glucosa 72 mg/dL La PCO2 ha disminuido 9 (31), aceptable.
Albúmina 4.0 mg/dL Acidosis metabólica compensada.
Regla 5… Nuevo reto.
William L Whittier, Gregory W Rutecki "Primer on clinical acid-base problem solving" Disease-a-Month - March 2004
(Vol. 50, Issue 3, Pages 122-162, DOI: 10.1016/j.disamonth.2004.01.002)](https://image.slidesharecdn.com/gasometras4dummies-120728013617-phpapp02/85/Interpretacion-de-gasometrias-36-320.jpg)