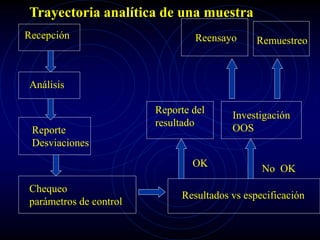
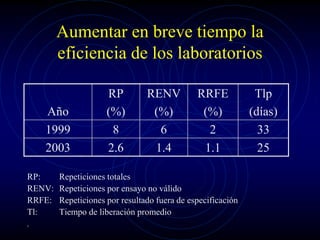
Este documento describe la implementación de un sistema de calidad en los laboratorios de control del Centro de Ingeniería Genética y Biotecnología en Cuba. El objetivo era diseñar e implantar un sistema de calidad que cumpliera con las Buenas Prácticas de Laboratorio y regulaciones internacionales para garantizar la exactitud de los resultados analíticos. Se definieron los elementos del sistema, procedimientos y etapas de implantación, lo que ha permitido la certificación por la OMS y el éxito en inspecciones regulatorias. El sistema ha llevado a mejor