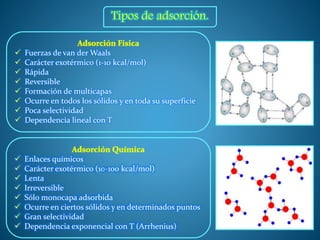
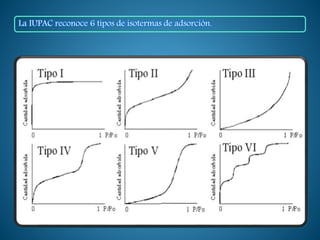
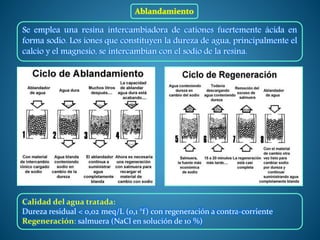
La adsorción es un proceso de transferencia de masa en el que átomos o moléculas de una sustancia en fase fluida se concentran en la superficie de otra sustancia en fase sólida. La sustancia concentrada en la superficie se denomina adsorbato y la sustancia sólida se denomina adsorbente. La adsorción se utiliza para separar componentes de mezclas gaseosas o líquidas acumulando el componente a separar en la superficie del adsorbente sólido.