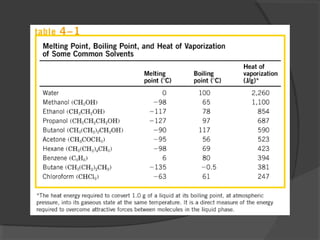
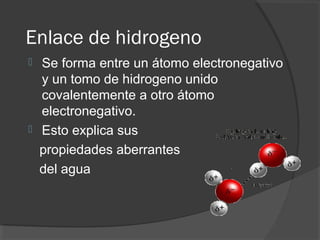
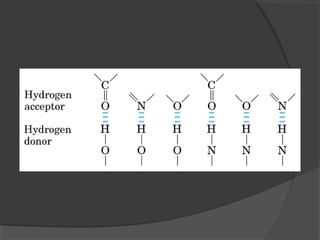
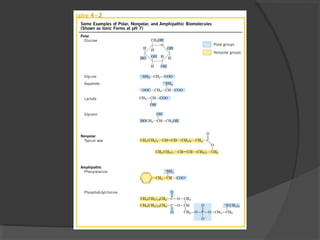
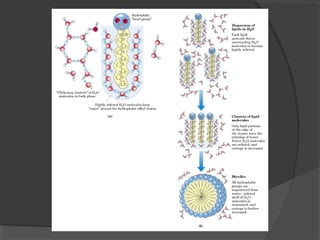
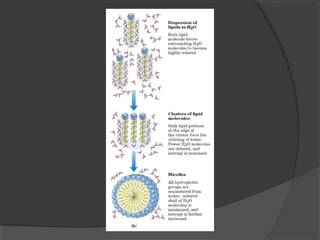
El agua es el componente más abundante en el cuerpo humano, representando el 65% del peso total. No hay procesos vitales que no involucren al agua de alguna forma. El agua tiene puntos de fusión y ebullición únicos, y puede disociar sustancias iónicas y polares debido a su polaridad y capacidad de formar enlaces de hidrógeno, lo que explica sus propiedades anómalas como solvente y su habilidad para conducir la corriente eléctrica cuando es electrolito.