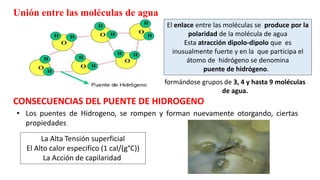
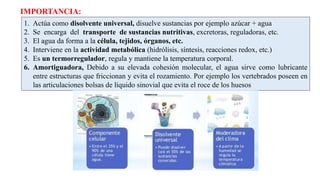
El agua es la biomolécula más abundante en los seres vivos. Cumple funciones esenciales como disolvente universal, transporte de sustancias, mantenimiento de la forma celular y regulación térmica. El cuerpo humano contiene entre un 75-85% de agua, siendo indispensable para todos los procesos fisiológicos.