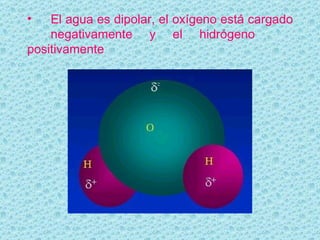
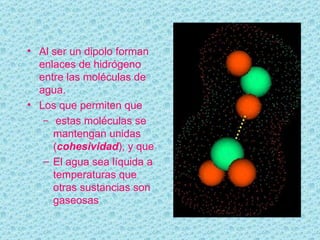
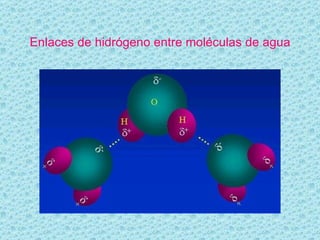
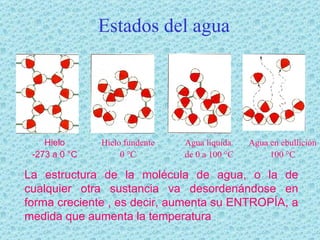
El documento describe las propiedades del agua. El agua es la molécula más abundante en los organismos vivos y constituye alrededor del 70% del peso celular. Está formada por dos átomos de hidrógeno y uno de oxígeno. Las moléculas de agua se unen mediante enlaces de hidrógeno, lo que le da propiedades únicas como su capacidad de disolución y su comportamiento anómalo al cambiar de estado. El agua es esencial para los procesos químicos y la regulación de temper