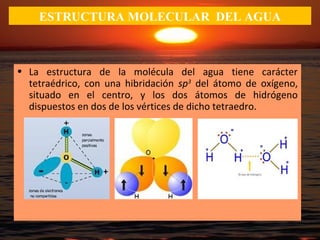
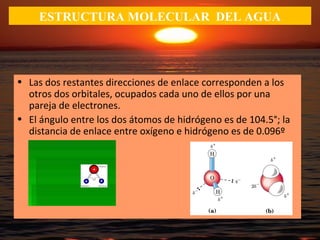
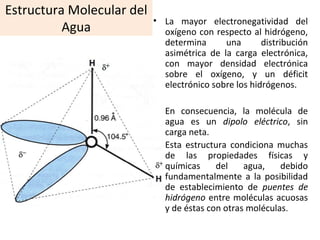
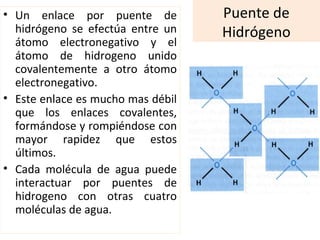
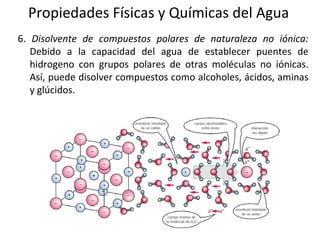
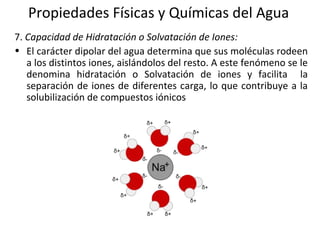
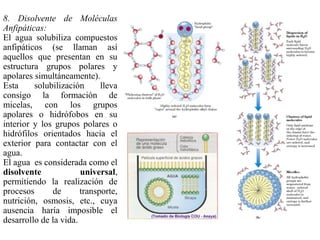
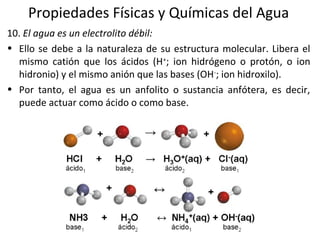
El documento describe las propiedades fundamentales del agua y su importancia para la vida. El agua es un componente esencial de todos los seres vivos y es indispensable para la vida en la Tierra. Posee propiedades únicas como su elevado calor específico, punto de ebullición y capacidad para disolver moléculas polares que permiten la existencia de la vida en una amplia gama de temperaturas. Además, el agua puede actuar como ácido o base débil y autoionizarse, lo que es crucial para mantener el pH corporal.















![pH
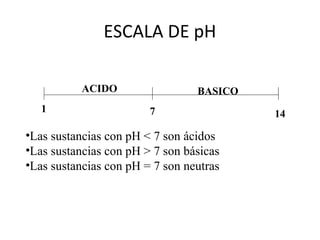
• Al disolver un ácido en agua, este se
disociará totalmente (ácido fuerte) ó
parcialmente (ácido débil) produciendo
determinada [ H+
] en la solución.
–Mientras mas fuerte sea el ácido, mayor
será la [H+
]
• Se define el pH de una solución como:
pH = - log [H+
] = log 1/[H+
]](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-24-320.jpg)

![Definición de pOH
• Definimos pOH como:
pOH = - log [OH-] = log 1/[OH-]
• De las definiciones de pH y pOH se puede
concluir que:
[H+
] = 10 –pH
[OH-
] = 10-pOH](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-28-320.jpg)
![Agua pura: [H3O+
] = [OH−
] ; [H3O+
] = 10-7
⇒ pH = 7
[OH−
] = 10-7
⇒ pOH = 7
DISOLUCIÓN
NEUTRA
[H3O+
] = [OH−
]
pH = 7
DISOLUCIÓN
ÁCIDA
[H3O+
] > [OH−
]
pH < 7
DISOLUCIÓN
BÁSICA
[H3O+
] < [OH−
]
pH > 7
pH
7
ácida básica](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-29-320.jpg)
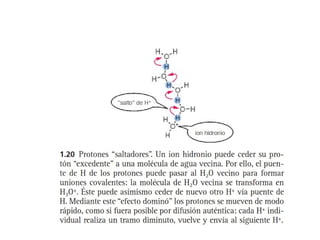
![H2O(l)
H3O+
(ac) OH-
(ac)
H2O(l)
[H+] [OH-]
K =---------------------
[H2O]
Kw = K [H2O] = [H+] [OH-] = 1x 10-14
Auto ionización del agua](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-30-320.jpg)
![Producto iónico del agua
Kw = [H+] [OH-] = 1x 10-14
Si aplicamos - log:
- log Kw = - log [H+] [OH-] = - log 1x
10-14
pKw = - log [H+] – log [OH-] = 14
pKw = pH + pOH = 14](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-32-320.jpg)


![Características importantes de una disolución amortiguadora:
* Su pH ⇒ depende de Ka y de las concentraciones
* Su capacidad amortiguadora
Capacidad amortiguadora: Cantidad de ácido o base que se puede
agregar a un tampón antes de que el pH comience a cambiar de
modo apreciable.
¿De qué depende?
* Del número de moles de ácido y base
(deben ser altos para que la capacidad también lo sea)
* Del cociente [base]/[ácido].
(para que la capacidad sea alta, ha de ser próximo a 1.
Si es < 0.1 ó > 10, no será muy eficiente.
Mayor eficiencia: cuando pH = pKa)](https://image.slidesharecdn.com/agua-130610181142-phpapp02/85/Agua-36-320.jpg)






