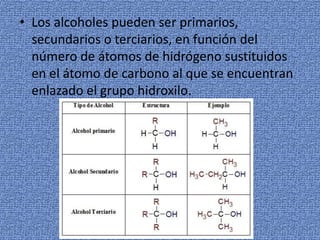
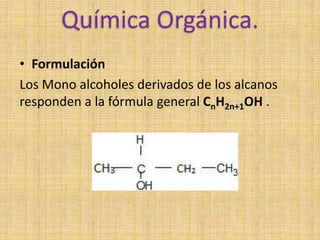
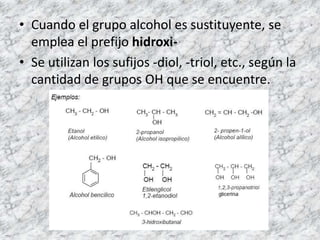
Los alcoholes se caracterizan por tener un grupo hidroxilo unido a un átomo de carbono. Pueden ser primarios, secundarios o terciarios dependiendo del número de átomos de hidrógeno sustituidos. Los alcoholes pueden oxidarse para formar aldehídos o ácidos carboxílicos, o deshidratarse para formar alquenos.



![Acidez de los alcoholes
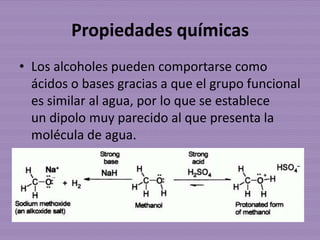
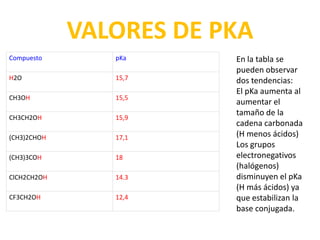
• La gran electronegatividad del oxígeno provoca
que el hidrógeno pueda ser arrancado por bases.
La acidez de los alcoholes viene dada por la
constante del siguiente equilibrio, cuyo logaritmo
cambiado de signo nos da el pKa.
CH3OH + H2O ↔ CH3O- + H3O+
Ka = [CH3O-][H3O+]/[CH3OH]
pKa = -logKa](https://image.slidesharecdn.com/alcohovvl-121002181729-phpapp02/85/Alcohol-13-320.jpg)
