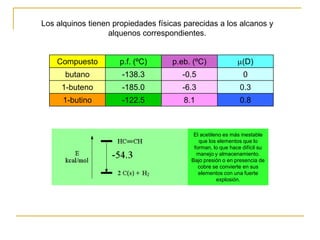
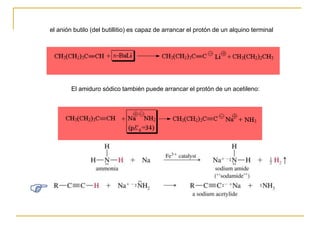
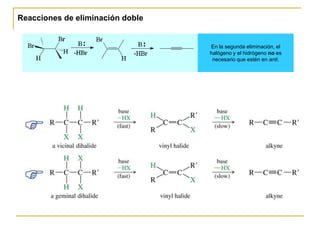
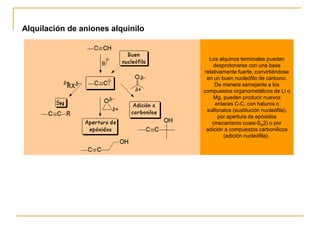
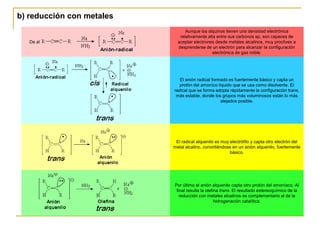
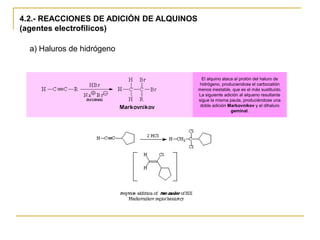
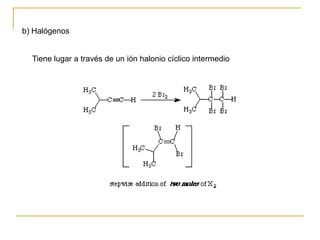
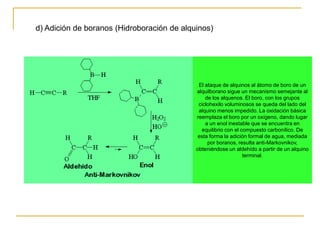
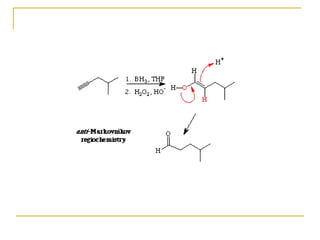
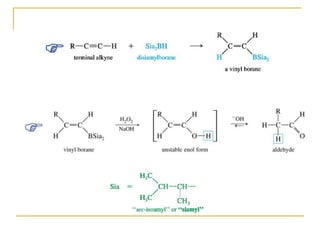
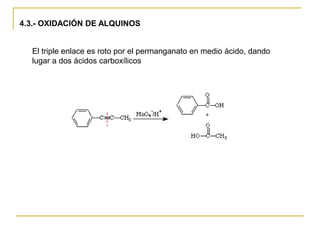
El documento trata sobre los alquinos. Resume lo siguiente:
1) El acetileno es el alquino más simple y tiene importancia industrial al liberar gran cantidad de energía al quemarse.
2) Los alquinos tienen un enlace triple constituido por solapamiento de orbitales sp y p, lo que les da propiedades como enlace lineal y alta reactividad.
3) Se pueden preparar por eliminación doble, alquilación de aniones alquinilo, y formación de alcoholes acetilénicos.