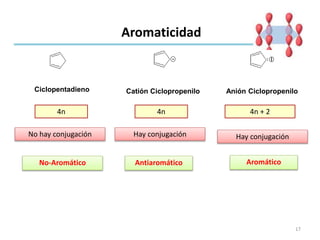
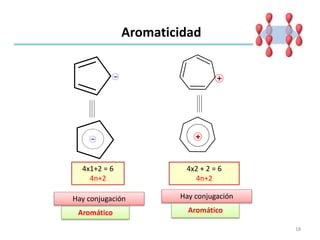
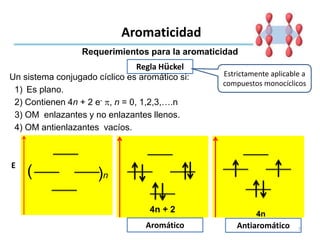
Este documento trata sobre la aromaticidad en compuestos orgánicos. Explica que los compuestos aromáticos deben cumplir con la regla de Hückel, siendo sistemas conjugados cíclicos con 4n + 2 electrones pi. También analiza varios compuestos como el benceno, naftaleno y antraceno para determinar si cumplen con los requisitos para ser aromáticos.


![Todas las moléculas a continuación:
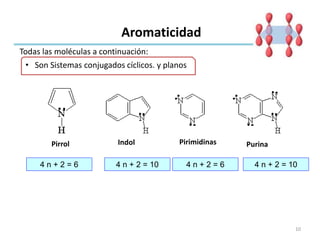
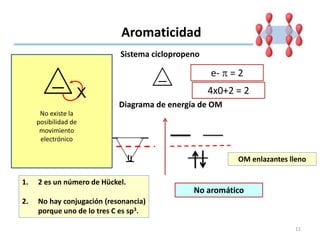
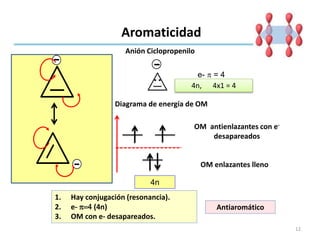
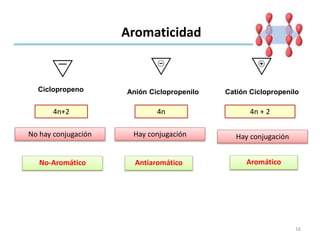
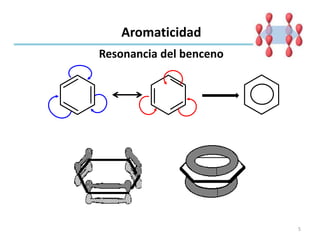
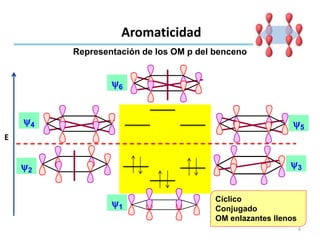
Aromaticidad
• Son Sistemas conjugados cíclicos. y planos
Naftaleno Antraceno
Fenantreno
Benceno
[18]-Anuleno
Tiofeno
Sólo un par de electrones
del azufre ocupa un orbital
p que forman parte de la
nube electrónica p
aromática.
8](https://image.slidesharecdn.com/tema4-170131112649/85/Tema-4-aromaticidad-8-320.jpg)