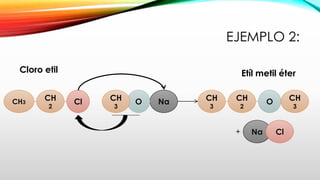
El documento describe los métodos para formar iones alcóxidos utilizando sodio o potasio metálico con alcoholes. El sodio se usa normalmente con alcoholes primarios mientras que el potasio es más reactivo y se usa con alcoholes secundarios y terciarios. Alternativamente, el hidruro de sodio puede usarse para formar alcóxidos incluso con alcoholes impedidos. Los iones alcóxidos luego pueden reaccionar con haluros de alquilo primarios para formar éteres a través de la