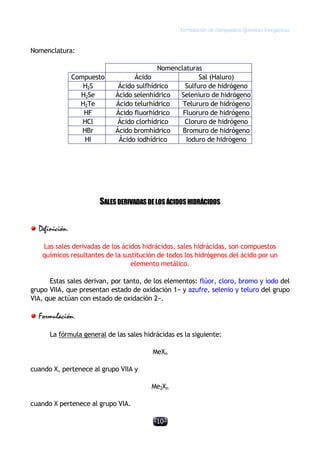
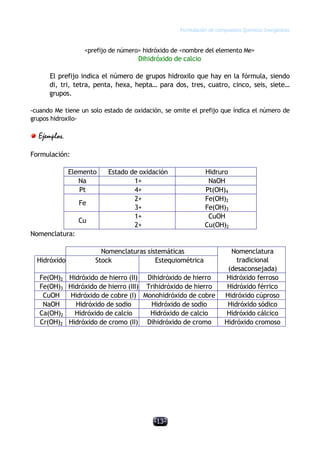
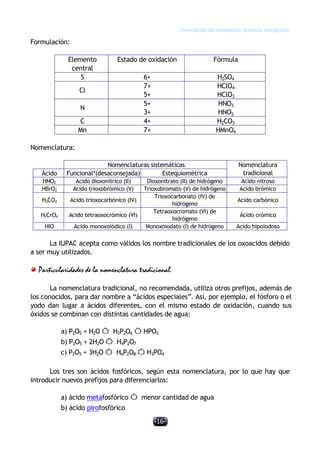
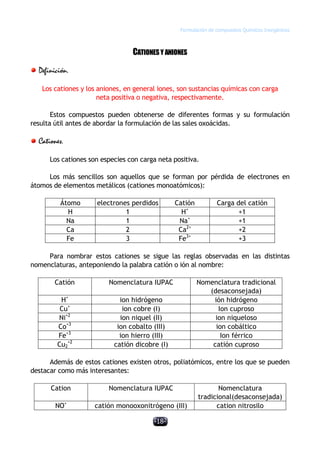
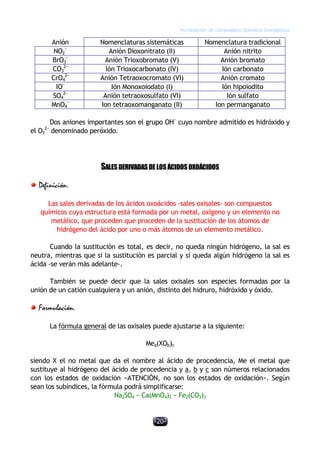
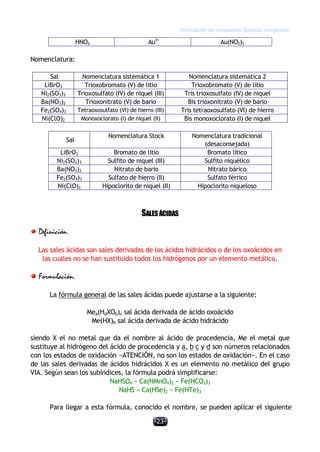
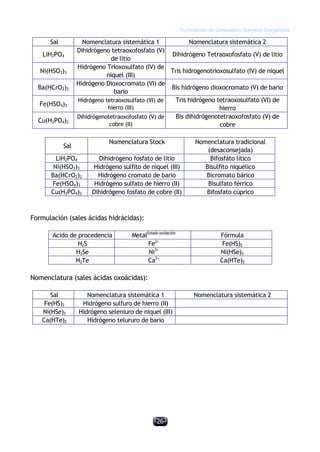
Este documento describe las normas establecidas por la IUPAC para la formulación y nomenclatura de compuestos químicos inorgánicos. Explica las reglas para representar sustancias simples, óxidos, hidruros y otros tipos de compuestos, incluyendo sus nombres sistemáticos y tradicionales. También clasifica los compuestos inorgánicos en familias como sustancias simples, compuestos binarios, ternarios y otros grupos.