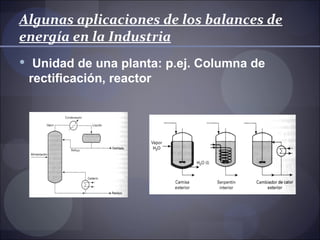
El documento describe el balance de energía. Explica que la energía no puede crearse ni destruirse, sino solo transformarse. Detalla las formas en que la energía puede intercambiarse entre un sistema y su entorno, incluida la energía interna, cinética, potencial, calor y trabajo. Además, explica cómo aplicar el balance de energía a sistemas cerrados y abiertos.