El documento proporciona información sobre las propiedades químicas y físicas del galio. El galio es un metal blando que se derrite a una temperatura baja de 29.5°C. Forma compuestos como el hidróxido de galio y sales de galio. Pequeñas cantidades de galio no son dañinas para los humanos pero algunos compuestos como el cloruro de galio pueden ser tóxicos si se está expuesto a altas dosis. El galio tiene usos potenciales aunque actualmente carece de aplicaciones prácticas
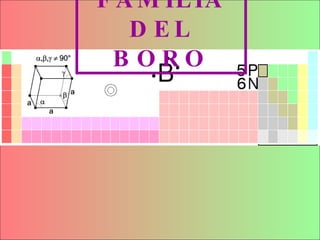



![Características principales Del BORO (B) Nº atómico:5 Densidad (g/ml) 2,34 Estructura Cristalina: Hexagonal Configuración electrónica:[He]2s2p 1 Metaloide Semiconductor Estado de la materia: sólido (no magnético) Tª fusión: 2349K Tª ebullición: 4200K Trivalente Existe en abundancia en el mineral borax No se ha encontrado libre en la naturaleza.](https://image.slidesharecdn.com/boro21-100115104523-phpapp02/85/Boro2-1-5-320.jpg)






![ALUMINIO Propiedades Químicas Rápida formación de capa de óxido de aluminio (Alúmina Al 2 O 3 ) impermeable y adherente que detiene el proceso de oxidación, lo que le proporciona resistencia a la corrosión y durabilidad. (Debido a su elevado estado de oxidación impermeable y adherente) . La capa de oxido formada sobre el aluminio se puede disolver en ácido cítrico formando citrato de aluminio. El aluminio tiene características anfóteras . Se disuelve tanto en ácidos (formando sales de aluminio) como en bases fuertes (formando aluminatos con el anión [Al(OH) 4 ] - ) liberando hidrógeno. Estado de oxidación +III como es de esperar por sus tres electrones en la capa de valencia.](https://image.slidesharecdn.com/boro21-100115104523-phpapp02/85/Boro2-1-12-320.jpg)




![GALIO GRUPO DEL BORO Número atómico:31 Grupo:13 Periodo:4 Configuración electrónica:[Ar] 3d 10 4s 2 4p 1 Estados de oxidación:+3 Electronegatividad:1.81 Radio atómico / pm:122.1 Masa atómica relativa:69.723 ± 0.001 H He Li Be B C N O F Ne Na Mg Al Si P S Cl Ar K Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn Ga Ge As Se Br Kr Rb Sr Y Zr Nb Mo Tc Ru Rh Pd Ag Cd In Sn Sb Te I Xe Cs Ba Hf Ta W Re Os Ir Pt Au Hg Tl Pb Bi Po At Rn Fr Ra Rf Db Sg Bh Hs Mt Ds Rg Uub Uut Uuq Uup Uuh La Ce Pr Nd Pm Sm Eu Gd Tb Dy Ho Er Tm Yb Lu Ac Th Pa U Np Pu Am Cm Bk Cf Es Fm Md No Lr](https://image.slidesharecdn.com/boro21-100115104523-phpapp02/85/Boro2-1-17-320.jpg)



























